工业生产粗硅的反应有:
SiO2+2C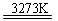 Si(粗)+2CO↑;SiO2+3C
Si(粗)+2CO↑;SiO2+3C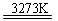 SiC+2CO↑。
SiC+2CO↑。
(1)若产品中粗硅与碳化硅的物质的量之比为1∶1,则参加反应的C 和SiO2的质量比为______________。
(2)粗硅进一步制备纯硅的原理如下:
Si(粗)+2Cl2(g)  SiCl4(l); SiCl4+2H2
SiCl4(l); SiCl4+2H2 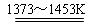 Si(纯)+4HCl。
Si(纯)+4HCl。
若上述反应中Si(粗 )和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂_______________吨。
)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂_______________吨。
(3)工业上还可以通过如下图所示的流程制取纯硅:
若反应①为:Si(粗)+3HCl(g)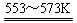 SiHCl3(l)+H2(g);
SiHCl3(l)+H2(g);
则反应②的化学方程式为___________________________________ 。
假设每一轮次生产过程中,硅元素没有损失,反应①中HCl的利用率为α1,反应②中H2的利用率为α2,,若制备1mol纯硅,在第二轮次的生产中,现补充投入HCl和H2的物质的量之比是5∶1。则α1与α2的代数关系式为____________________________。
Ⅰ、(1)高锰酸钾是一种典型的强氧化剂。
(1)在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
Ⅰ. MnO4-+ Cu2S + H+→ Cu2+ + SO2↑ + Mn2+ + H2O(未配平)
Ⅱ. MnO4-+ CuS + H+ → Cu2+ + SO2↑ + Mn2+ + H2O(未配平)
请回答下列问题:
①下列关于反应Ⅰ的说法不正确的是。
| A.被氧化的元素是Cu和S |
| B.MnO4-是氧化剂,Cu2S既是氧化剂又是还原剂 |
| C.氧化剂与还原剂的物质的量之比为8∶5 |
| D.生成2.24 L(标况下) SO2,转移电子的物质的量是0.8 mol |
E.氧化性的强弱关系是: MnO4-> Mn2+> Cu2+
②用单线桥表示反应Ⅱ中电子转移的数目和方向:MnO4-+ CuS
(2)在稀硫酸中,MnO4-和H2O2也能发生氧化还原反应:
氧化反应: H2O2 - 2e-==2H++O2↑
还原反应: MnO4-+5e-+ 8H+===Mn2++4H2O
写出该氧化还原反应的化学方程式:。
反应中若有0.5 mol H2O2参加此反应,转移电子的个数为。由上述反应得出的氧化性强弱的结论是。
②实验中发现,当加入的少量KMnO4完全反应后,H2O2仍能发生反应放出气体。其可能的原因是:。
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B,D。
(2)将含lmol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,该化合物化学式为。
(3)C常用作净水剂,用离子方程式表示其净水原理。
(4)在A溶液中加入少量澄清石灰水,其离子方程式为
(5)向20mL 2mol/L C溶液中加入30mL E溶液,充分反应后得到0.78g沉淀,则E溶液的物质的量浓度可能是moI/L。
回收的废旧锌锰干电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、乙炔和黑炭等),由锰粉制取MnO2的步骤如下图所示。
生成氢氧化物沉淀的pH
| 物质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.6 |
| Mn(OH)2 |
8.3 |
9.8 |
根据上图所示步骤并参考表格数据,回答下列问题。
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等。MnO2与浓盐酸反应的离子方程式为___________________________________________
(2)锰粉经浓盐酸浸取,过滤Ⅰ除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是____________________________________________________________。
(3)过滤Ⅰ所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目的是___________________________________________________________。
(4)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为_____________________________________________。
(5)实验室进行过滤操作时,需要用到的玻璃仪器有________________________
分析下面两个案例并回答有关问题。
(1)某城镇生产、生活的分布情况如图所示,河流中W、X、Y、Z处某次水样抽测结果如表所示。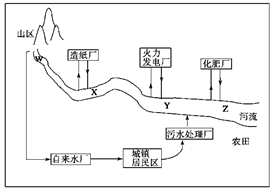
| 地点 项目 |
W |
X |
Y |
Z |
| 水温/℃ |
15 |
18 |
26 |
25 |
| pH |
6 |
8 |
5 |
5 |
| 溶解氧量/(mg·L-1) |
11 |
9 |
7 |
3 |
①导致X、Y处水样pH变化的原因可能是_______________________________
②Z处鱼类大量减少,产生这种现象的原因可能是_______________________
(2)某地区已探明蕴藏着丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土。拟在该地区建设大型炼铁厂。
①随着铁矿的开发和炼铁厂的建立,需要在该地区相应建立焦化厂、发电厂、水泥厂等,形成有规模的工业体系。据此确定上图中相应工厂的名称:
A________、B________、C________、D________;
②以赤铁矿为原料,写出高炉炼铁中得到生铁和产生炉渣的化学方程式_____;
③从“三废”利用、环境保护等角度考虑,该地区和企业在生产中应采取的一些措施有(举出2种措施即可)______________________________________________________________
在国际环境问题中,一次性使用聚苯乙烯材料带来的“白色污染”极为严重,这种材料难分解、处理麻烦,最近研制的一种可降解塑料,代号为3HB,结构简式为 具有良好的生物适应性,能在自然界降解。请回答下列问题:
具有良好的生物适应性,能在自然界降解。请回答下列问题:
(1)该可降解塑料在自然界中可通过________(填序号)反应降解为该聚合物的单体
| A.加成 | B.消去 | C.水解 | D.氧化 |
(2)该聚合物的单体的结构简式为_________________________________________,
该单体中具有的官能团的名称为______________。
(3)各取1 mol该单体分别与钠和碳酸氢钠溶液完全反应时,分别消耗钠和碳酸氢钠物质的量之比为________。