向1 L 0.3 mol/L的NaOH溶液中缓缓通入CO2气体至溶液增重8.8 g,下列说法中不正确的是
| A.溶质为Na2CO3和NaOH |
| B.溶质为Na2CO3和NaHCO3 |
| C.2c(Na+)/3 = c(HCO3-) + c(CO32-) + c(H2CO3) |
| D.c(Na+) = c(HCO3-) + 2c(CO32-) + c(OH-) - c(H+) |
下表中所示物质或概念间的从属关系符合下图的是
| X |
Y |
Z |
|
| A |
钠元素 |
主族元素 |
短周期元素 |
| B |
氢氧化铁(固体) |
胶体 |
分散系 |
| C |
电解质 |
化合物 |
纯净物 |
| D |
置换反应 |
氧化还原反应 |
放热反应 |
下列参数比较及解释均正确的是
| 选项 |
参数 |
比较 |
解释 |
| A |
沸点 |
HF<HCl<HI |
组成结构相似的物质,相对分子质量越大沸点越高 |
| B |
半径 |
Na+﹥Al3+﹥S2- |
同一周期粒子半径随原子序数的递增逐渐减小 |
| C |
酸性 |
H2SO3>H2CO3 |
元素的非金属性越强,其含氧酸的酸性越强 |
| D |
还原性 |
P3->S2->Cl- |
元素的非金属性越强,简单阴离子的还原性越弱 |
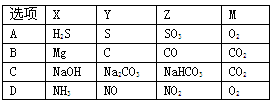
下表各组物质中,物质之间不可能实现如图所示转化的是
设NA为阿伏伽德罗常数的值。下列说法正确的是
①28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA
②1 L 0.1 mol·L-1的氨水中含有NH3·H2O分子数为0.1NA
③1 mol Na2O2固体与足量CO2反应转移电子数为1NA
④标准状况下,2.24 L的二氯甲烷中含有的碳氯共价键的数目为0.2NA
| A.4个 | B.3个 | C.2个 | D.1个 |
化学与科学、社会、技术和环境密切相关。下列有关说法中错误的是
| A.目前科学家已制得单原子层锗,其电子迁移率是硅的10倍,有望用于制造高能计算机芯片 |
| B.2014年在西非国家爆发了埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
| C.CO2、CH4、氟氯代烃等都会造成温室效应,因此都属于大气污染物 |
| D.绿色化学期望利用化学原理从源头消除污染,在生产过程中充分利用原料,实现零排放 |