在T℃条件下,向1L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应: 2X(g) + Y(g)  a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则:
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则:
(1)化学计量数a的值为 。
(2)下列说法中能说明该反应达到了化学平衡状态的是 。
A.容器内压强一定 B.容器内气体的密度一定
C.容器内Z分子数一定 D.容器内气体的质量一定
(3)X的转化率α= (用含Q、Q1的代数式表示)。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr
B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W
D.2 molX、1mol Y、1molZ
(5)维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小了10%,则反应中放出的热量为 kJ。
已知:该反应的平衡常数随温度的变化如下表:
| 温度/℃ |
200 |
250 |
300 |
350 |
| 平衡常数K |
9.94 |
5.2 |
1 |
0.5 |
试回答下列问题
(6)在300℃发生上述反应,以表中的物质的量投入到相同的恒容反应器中,其中向正反应方向转化的有 (选填A.B.C.D.E)。
| |
n(X) |
n(Y) |
n(Z) |
n(W) |
| A |
1 |
5 |
2 |
3 |
| B |
2 |
2 |
1 |
1 |
| C |
3 |
3 |
0 |
6 |
| D |
0.5 |
2 |
1 |
1 |
| E |
1 |
0.3 |
2 |
2 |
(7)若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡, X的平衡转化率为50%,则该温度为 ℃。
(8)维持T℃条件不变,若在一个和原容器体积相等的恒压容器N 中,加入2 mol X和1 mol Y发生如上反应并达平衡,则 (选填M或N)容器中的反应先达到平衡状态。
在一定条件下的下列可逆反应达到平衡时,试填出:xA+yB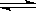 zC
zC
(1)若A、B、C都是气体,增大压强,平衡向正反应方向移动,则x+y与z关系是_______;
(2)若A、C是气体,且x+y=z,在加压时化学平衡可发生移动,则平衡必定是向方向移动;
(3)若B、C是气体,A是固体,增大A的浓度,平衡(填“正向移动”、“逆向移动”或“不移动”);
(4)若升高温度后,C的百分含量减小,则正反应是(填“吸热”或“放热”)反应。
(5)若该可逆反应达到平衡时加入催化剂,平衡(填“正向移动”、“逆向移动”或“不移动”);
完成并配平下列化学方程式□FeO + □HNO3→ □Fe(NO3)3 + NO↑+ □,当生成2mol NO时,转移的电子数为NA。
有一无色干燥的混合气体,可能是由HCl、NO、NO2、CO2、NH3、H2、O2、Cl2中的几种混合而成。对混合气体进行如下操作:①混合气体通过浓H2SO4时,气体体积明显减小;②再通入过量碱石灰时,体积又明显减小;③剩余气体接触空气时,立即变为红棕色。混合气体中一定存在,一定不存在,可能存在。
在一定条件下的下列可逆反应达到平衡时,试填出:xA+yB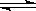 zC
zC
(1)若A、B、C都是气体,增大压强,平衡向正反应方向移动,则x+y与z关系是_______;
(2)若B、C是气体,A是固体,增大A的浓度,平衡(填“正向移动”、“逆向移动”或“不移动”);
(3)若升高温度后,C的百分含量减小,则正反应是(填“吸热”或“放热”)反应。
(4)若该可逆反应达到平衡时加入催化剂,平衡(填“正向移动”、“逆向移动”或“不移动”);
农业上常说:“下一场雷雨相当于追一次肥,”即雷雨对农作物的生长有利。请尝试用化学方程式解释原因:
;;;