通常情况下,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。为减小和消除CO2对环境的影响,各国都在限制CO2的排量,同时也加强对CO2创新利用的研究。
(1)目前,推广用超临界CO2(介于气态和液态之间)代替氟利昂作致冷剂,这一做法对环境的积极意义是 。
(2)科学家为提取空气中的CO2,把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应使之变为可再生燃料甲醇。流程如图: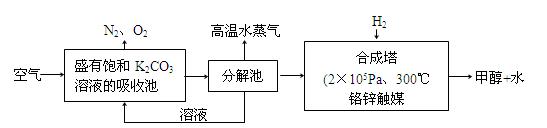
①分解池中反应的化学方程式为: 。
②合成塔中,若有4.4g CO2与足量H2恰好反应生成气态产物,放出4.947kJ的热量,写出该反应的热化学方程式: 。
(3)某同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积Ksp分别为4.96×10-9、2.58×10-9。他最好将空气通入足量的 溶液,实验时除测定温度、压强和空气的体积外,还需测定 。
碳化硅(SiC) 、氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。宇宙火箭和导弹中,大量用钛代替钢铁。
(1)Al的离子结构示意图为;
Al与NaOH溶液反应的离子方程式为
(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,
其反应方程式为
(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + x N2(g) + 6 H2(g) Si3N4(s) + 12 HCl(g) △H<0
Si3N4(s) + 12 HCl(g) △H<0
在恒温、恒容时,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2 L密闭容器内,进行上述反应,5 min达到平衡状态,所得HCl(g)为0.3mol/L、 N2为0.05 mol/L
① H2的平均反应速率是
② 反应前与达到平衡时容器内的压强之比=
③ 系数 x =
(4)已知:TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH1=+140 kJ·mol-1
C(s)+ O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1
O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
。
A、B、C三元素原子的核外电子数都比氩原子少, A和C处于同主族, 两
者间隔一周期, A元素和B元素的原子两者核电荷数之差为5, B原子核外M层比L层少2个电子, 则:
(1)B原子的电子式为__________;A离子的结构示意图为_____________。
(2)C原子核里含有一个中子的原子的符号为_________,用电子式表示A与B所形成化合物的形成过程 。
(3)A元素在周期表中的位置为_____________________。
下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝,X分解产生A、B、C三种产物的比值为1:1:1。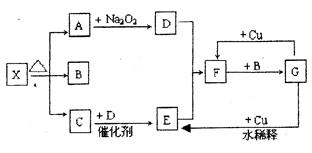
(1)写出下列各物质的化学式:
X:;B:;F:;G:。
(2)按要求写出下列变化的反应化学方程式:
A→D的化学反应方程式:;
G→E的离子反应方程式:。
下表是元素周期表的前三周期,针对表中A~G七种元素填空:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|||||||
| 2 |
B |
C |
D |
|||||
| 3 |
E |
F |
G |
(1)A、B两种元素组成相对分子质量最小的化合物,其分子的空间结构为。
(2)七种元素中的最高价氧化物对应水化物的酸性最强的是(用化学式表示,下同);碱性最强的是,该化合物属于。(选填离子或共价化合物),该化合物的电子式为,所含化学键类有、。
(3)用A、D的单质可以制成燃料电池,电池中装有E的最高价氧化物的水化物的浓溶液作电解质溶液,用多孔的金属惰性电极浸入上述浓溶液中,在X极通入D的单质,Y极通入A的单质,则Y极是该电池的极(选填正极或者负极),X极的电极反应式是。当电池中转移1mol 电子时,消耗A单质的体积为L(标况)。
下面列出了几组物质,请将物质的合适组号填写在空格上。
① 氧气(O2)与臭氧(O3); ②16O、17O和18O; ③ CH4和CH3CH2CH3;
④ ⑤(CH3)2CHCH2CH3 和C(CH3)4
⑤(CH3)2CHCH2CH3 和C(CH3)4
(1)同位素;(2)同种物质;(3)同分异构体;(4) 同系物。