下列推断合理的是
| A.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 |
| B.将SO2分别通入品红和溴水溶液,溶液都会褪色,而且再经加热都能恢复原色 |
| C.浓H2SO4,具有强氧化性,不能与Cu发生剧烈反应 |
| D.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
“三效催化转换器”可将汽车尾气中的有毒气体处理为无污染的气体,下图为该反应的微观示意图(未配平),其中不同颜色的球代表不同种元素的原子。下列说法正确的是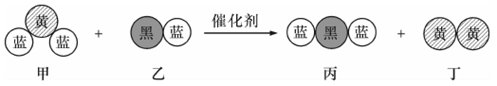
| A.该反应属于置换反应 |
| B.化学方程式中乙、丙的化学计量数均为4 |
| C.甲和丁中同种元素化合价相等 |
| D.甲和丙中所含元素种类相同 |
下列关于有机物的叙述正确的是
| A.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 |
| B.除去乙烷中少量的乙烯,可在光照条件下通入Cl2,再气液分离 |
| C.乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 |
| D.蛋白质、葡萄糖、油脂均能发生水解反应 |
化学与环境、材料、信息、能源关系密切,下列说法不正确的是
| A.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 |
| B.“光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关 |
| C.尽量使用含12C的产品,减少使用含13C或14C的产品符合“促进低碳经济”宗旨 |
| D.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
下列关于有机物的叙述正确的是
| A.棉花、羊毛、粘胶纤维均属于天然纤维 |
| B.乙烯和苯均能使酸性高锰酸钾溶液褪色 |
| C.淀粉和纤维素都能在一定条件下发生水解反应生成葡萄糖 |
| D.将铜片在酒精灯上加热变黑后迅速插入乙醇溶液中,铜片恢复红色且质量减小 |