硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下: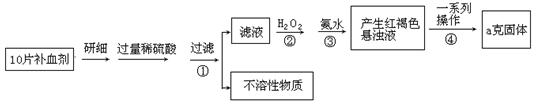
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是 。
(2)写出②中的离子反应方程式: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、冷却、称量。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4—+8H+→5Fe3++Mn2++4H2O)
① 实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除药匙、天平(附砝码)、玻棒、烧杯、胶头滴管外,还需 。
②滴定到终点时的颜色为 色。
(6)正常人每天应补充16.8mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂。来补充铁,则正常人每天服需用含 mgFeSO4·7H2O片剂。
实验室需要480 mL 0.4mol/L的NaCl溶液,有如下操作步骤:
①.把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解。
②.把①所得溶液小心转入一定容积的容量瓶中。
③.继续向容量瓶中加蒸馏水至液面距刻度线1 cm~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切。
④.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤.将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)。
(2)实验室有如下规格的容量瓶:①100 mL,②250mL,③500 mL,④1000 mL。本实验选用(填序号)。
(3)本实验用到的基本仪器除容量瓶、玻璃棒外还有。
(4)需要使用玻璃棒的操作有(填序号),其作用为。
(5)误差分析:(填“偏高”、“偏低”或“无影响”)
①.称量NaCl时,物码倒置(1 g以下用游码);
②.容量瓶使用前,用0.4mol/L的NaCl溶液润洗。
在某次实验中,要用500mL 0.52 mol·L-1的NaOH溶液,回答下列问题:
(1)配制NaOH溶液时需用的主要仪器有托盘天平(附砝码、镊子)、药匙、量筒、烧杯、胶头滴管、和;
(2)下列操作对所配浓度有何影响(填写字母)?
偏大的有;偏小的有。
| A.称量时用了生锈的砝码; |
| B.将NaOH放在纸张上称量; |
| C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中; |
| D.往容量瓶转移时,有少量液体溅出; |
E、定容时俯视刻度线;
F、容量瓶未干燥即用来配制溶液;
G、定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
已知A、B、C、D四种物质具有以下物理性质:
| A |
B |
C |
D |
|
| 分散到水中 |
得悬浊液 |
得无色溶液 |
液体分层,且下层为无色油状液体 |
得无色溶液 |
| 熔点(℃) |
1452 |
-21.3 |
-11.5 |
801 |
| 沸点(℃) |
1703 |
78.9 |
117 |
1210 |
(1)已知A与D不发生反应,且均不与水反应。
①.欲从A、D的混合物中分离提纯D,需进行的操作是:
a:溶解;b:(填操作名称,下同);c:。
②.上述a、b、c操作过程中均需用到的一种玻璃仪器为。
(2)从B的水溶液中分离出B的操作名称为。
(3)从C与水的混合物中分离提纯C所需的玻璃仪器有。
实验室需要480 mL 0.4mol/L的NaCl溶液,有如下操作步骤:
①.把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解。
②.把①所得溶液小心转入一定容积的容量瓶中。
③.继续向容量瓶中加蒸馏水至液面距刻度线1 cm~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切。
④.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤.将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)。
(2)实验室有如下规格的容量瓶:①100 mL,②250mL,③500 mL,④1000 mL,本实验选用(填序号)。
(3)本实验用到的基本实验仪器除容量瓶、玻璃棒外还有。
(4)需要使用玻璃棒的操作有(填序号),其作用为。
(5)误差分析:(填“偏高”、“偏低”或“无影响”)
①.称量NaCl时,物码倒置(1 g以下用游码);
②.容量瓶使用前,用1 mol/L的NaCl溶液润洗。
某校某班化学兴趣小组进行了下列两项试验活动:(1)探究草酸(H2C2O4)与高锰酸钾溶液在不同条件下反应的快慢;(2)测定草酸晶体的纯度。已知:①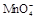 在酸性环境下的还原产物是
在酸性环境下的还原产物是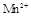 ;②草酸是二元弱酸。
;②草酸是二元弱酸。
Ⅰ.探究草酸与高锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入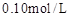 的草酸溶液
的草酸溶液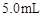 ,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
| 实验 编号 |
反应温度 (利用水浴加热) |
稀硫酸溶液 |
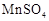 固体 固体 |
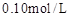 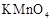 溶液 溶液 |
褪色时间 |
| 1 |
65℃ |
— |
— |
1.0mL |
100s |
| 2 |
65℃ |
10滴 |
— |
1.0mL |
90s |
| 3 |
75℃ |
10滴 |
— |
1.0mL |
40s |
| 4 |
75℃ |
10滴 |
加入少许 |
1.0mL |
3s |
根据以上4组实验,可以得出的结论主要有_______________________________。
Ⅱ.测定草酸晶体的纯度
用托盘天平称取草酸晶体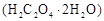 样品
样品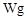 ;配制成
;配制成 溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶外还需要的一种玻璃仪器是____________。(填仪器名称)
(2)上述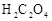 溶液与酸性
溶液与酸性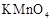 溶液反应的离子方程式为_________。
溶液反应的离子方程式为_________。
(3)若滴定过程中平均消耗酸性高锰酸钾溶液VmL,则草酸晶体的纯度为_______(以含W、V的表达式表示)。