Ⅰ)⑴已知:N2(g)+O2(g)=2NO(g);△H=+180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ·mol-1
2H2(g)十O2(g)=2H2O(g):△H=-483.6kJ·mol-1
则N2(g)+3H2(g) 2NH3(g)的△H= ▲ 。
2NH3(g)的△H= ▲ 。
⑵在一定条件下,将2molN2与5molH2混合于一个10L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3) ▲ ;
②达到平衡时NH3的体积分数为 ▲ 。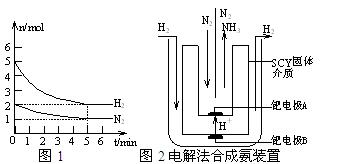
⑶近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A上发生的电极反应式是 ▲ 。
Ⅱ)甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
①CH4(g)+H2O(g)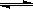 CO(g)+3H2(g) ΔH1
CO(g)+3H2(g) ΔH1
②CO(g)+2H2(g)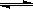 CH3OH(g) ΔH2
CH3OH(g) ΔH2
将0.20molCH4和0.30molH2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。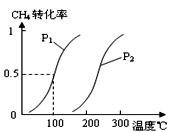
(1)温度不变,缩小体积,增大压强,①的反应速率 ▲ (填“增大”、“减小”或“不变”),平衡向 ▲ 方向移动。
(2)反应①的△H1 ▲ 0(填“<”、“=”或“>”)。
Zn MnO2干电池应用广泛,其电解质溶液是ZnCl2
MnO2干电池应用广泛,其电解质溶液是ZnCl2 NH4Cl混合溶液。
NH4Cl混合溶液。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(2)若ZnCl2 NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍镉(Ni Cd)电池,其电池总反应可以表示为:
Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O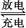 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是( )
①以上反应是可逆反应
②以上反应不是可逆反应
③充电时化学能转变为电能
④放电时化学能转变为电能
| A.①③ | B.②④ | C.①④ | D.②③ |
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为 。
已知氨水与醋酸的电离程度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①
N+H2O NH3·H2O+H+②
NH3·H2O+H+②
H++OH- H2O③
H2O③
由于N水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①
N+OH- NH3·H2O②
NH3·H2O②
由于NH4Cl电离出的N与Mg(OH)2电离出的OH-结合,生成了弱电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学解释只有一种正确,他选用的试剂是 (填写编号)。
| A.NH4NO3 |
| B.CH3COONH4 |
| C.Na2CO3 |
| D.NH3·H2O |
(2)请你说明丙同学作出该选择的理由是 。
(3)丙同学将所选试剂滴入Mg(OH)2悬浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 (填“甲”或“乙”);写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
(1)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 。已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,= 。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
25 ℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① ;
② ;
③ 。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01 mol·L-1的是 ,浓度为0.002 mol·L-1的是 。
(4) 和 两种粒子物质的量之和等于0.01 mol。