有一包粉末状固体,可能是由Al2(SO4)3、CuCl2、KNO3、Na2O中的一种或几种组成的。为了探究它的成分,某学习小组做了如下实验。
①取适量粉末投入蒸馏水中,粉末完全溶解,得到蓝色透明溶液A。
②取A溶液少量,向其中逐滴滴加烧碱溶液直到过量,观察到先有沉淀出现,而后沉淀逐渐增多,然后沉淀又逐渐减少,但最终仍有部分蓝色沉淀。
③再取A溶液两份,一份滴加BaCl2溶液后,出现白色沉淀;另一份滴加硝酸银溶液后也出现白色沉淀。请回答下列问题:
(1)原白色粉末一定含有  ,一定不含 ,可能含有 。(填化学式)
,一定不含 ,可能含有 。(填化学式)
(2)写出过程②中涉及到的离子方程式:
 。
。
(3)如果要进一步确定可能存在的物质,进行的实验操作及实验现象和结论是
。
下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。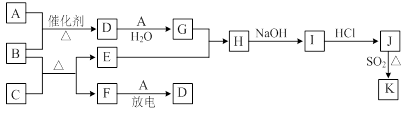
已知: A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1)D的化学式为;F的电子式为。
(2)A与B生成D的反应在工业上是生产的反应原理之一。
(3)E与G的稀溶液反应的离子方程式为。
(4)B和C反应的化学方程式为。
(5)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子
方程式。
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知:2SO2(g)+O2(g)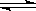 2SO3(g)△H=-196 kJ·mol-1。
2SO3(g)△H=-196 kJ·mol-1。
(1)该反应的平衡常数表达式为K=;某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正)v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是(填字母)。
| A.保持温度和容器体积不变,充入1.0 mol O2 |
| B.保持温度和容器内压强不变,充入1.0 mol SO3 |
| C.降低温度 |
| D.移动活塞压缩气体 |
(4)若以下图所示装置,用电化学原理生产硫酸,写出通入SO2电极的电极反应式。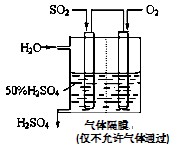
(5)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为______。
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: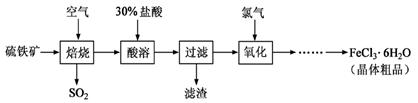
回答下列问题:
(1)过量的SO2与NaOH溶液反应的离子方程式为。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是、。
(3)通氯气氧化时,发生的主要反应的离子方程式为;该过程产生的
尾气可用碱溶液吸收,尾气中污染空气的气体为(写化学式)。
下表列出了核电荷数为21~25的元素的最高正化合价,回答下列问题:
| 元素名称 |
钪 |
钛 |
钒 |
铬 |
锰 |
| 元素符号 |
Sc |
Ti |
V |
Cr |
Mn |
| 核电荷数 |
21 |
22 |
23 |
24 |
25 |
| 最高正价 |
+3 |
+4 |
+5 |
+6 |
+7 |
(1)写出下列元素基态原子的核外电子排布式:
Sc____________________________ Ti_______________________________
V ____________________________ Mn ______________________________
(2)已知基态铬原子的电子排布是1s22s22p63s23p63d54s1,并不符合构造原理。人们常常会碰到客观事实与理论不相吻合的问题,当你遇到这样的问题时,你的态度是:___________________________________________________________。
(3)对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是__________________________________________________________;出现这一现象的原因是_________________________________________。
按照下列元素基态原子的电子排布特征判断元素,并回答问题。
A的原子中只有一个能层且只含1个电子;B的原子3p轨道上得到1个电子后不能再容纳外来电子;C的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;D的原子第三能层上有8个电子,第四能层上只有1个电子;E原子的外围电子排布为3s23p6。
(1)写出由A、B、C、D中的三种元素组成的化合物的化学式(至少写出5个):
;
(2)写出用上述元素组成的物质制得A的单质的化学方程式(至少写出2个):
、;
(3)检验某溶液中是否含有D+的离子,可通过______________反应来实现;检验某溶液中是否含有B—的离子,通常所用的试是_________和_______。
(4)写出E的元素符号___________,要证明太阳上是否含有E元素,可采用的方法是______________________。