已知25℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
|
| 平衡常数 |
Ka=1.8×10-5 |
Ka1=4.3×10-7 |
Ka2=5.6×10-11 |
Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClO d.NaHCO3; PH由小到大的排列顺序是___________________________
(2)常温下,0.1mol·L-1的的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是____
| A.c(H+) | B.c(H+)/ c(CH3COOH) | C.c(H+)·c(OH-) | D.c(OH-)/ c(H+) |
E. c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100mlPH=2的CH3COOH与一元酸HX,加水稀释过程中PH与溶液体积的关系如图所示,则HX的电离平衡常数_________CH3COOH的电离平衡常数(填大于小于或等于)理由是______________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得PH=6,则溶液中C(CH3COO-)—c(Na+)=____________mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=__________
(7分)某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程如图(写出最佳答案)。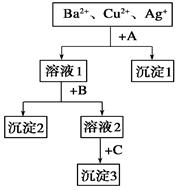
(1)沉淀的化学式:
沉淀1________________,沉淀 2________________,沉淀3________________;
2________________,沉淀3________________;
(2)写出混合液+A的离子方程式:__________
溶液1+B的离子方程式:_ _________。
_________。
(1) ( 6分) 书写下列离子方程式:
实验室制取CO2 ___ ___________________________________________________________________
___________________________________________________________________
硫酸铜溶液与氢氧化钡溶液_____________________________________
CO2 通入足量氢氧化钠_______________________________________
通入足量氢氧化钠_______________________________________
(2)写出下列物质的电离方程式:
NaHSO4_______,
H2CO3________。
(10分)以下12种物质为中学化学中常见的物质:
①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4⑥C2H5OH ⑦CaCO3 ⑧BaSO4 ⑨Cu(OH)2⑩Fe(OH)3 ⑪NaOH ⑫NH3·H2O
请按下列分类标准回答问题。
(1)属于电解质的是__________________________。
(2)能电离出H+的是________。
(3)属于碱的是________________,其中属于难溶性碱的是________。
(4)属于难溶性盐的是_______。
已知下列两个反应:①Fe+H2SO4(稀)====FeSO4+H2↑;
②Cu+2H2SO4(浓) CuSO4+SO2 ↑ +2H2O。试回答下列问题:
CuSO4+SO2 ↑ +2H2O。试回答下列问题:
(1)反应①中元素被还原,反应②中元素被还原。(填元素符号)
(2)当反应①生成2g H2时,消耗H2SO4的质量是。
(3)反应②中生成32g SO2气体时,消耗H2SO4的质量是 g ,其中有g H2SO4作为氧化剂被还原。
g ,其中有g H2SO4作为氧化剂被还原。
有A、B、 C、D、E五种无色溶液,它们是硝酸钙、稀盐酸、硝酸银、碳酸钠和氯化钡。各取少量进行两两混合实验,结果如下(表中“↓”表示有沉淀出现,“↑
C、D、E五种无色溶液,它们是硝酸钙、稀盐酸、硝酸银、碳酸钠和氯化钡。各取少量进行两两混合实验,结果如下(表中“↓”表示有沉淀出现,“↑
 ”表示有气体生成,“—”表示没有明显现象):
”表示有气体生成,“—”表示没有明显现象):
| A |
B |
C |
D |
E |
|
| A |
 |
↓ |
— |
↓ |
— |
| B |
↓ |
↓ |
— |
||
| C |
— |
↓ |
↑ |
— |
|
| D |
↓ |
↓ |
↑ |
↓ |
|
| E |
— |
— |
— |
↓ |
(1)请写出A、B、C、D 、E各溶液中溶质的化学式:
、E各溶液中溶质的化学式: ABCDE
ABCDE
(2)请写出A+B,C+D,D+E反应的离子方程式
①A+B:
②C+D:
③A+D: