电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
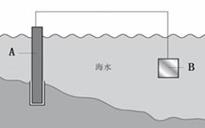
图1
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择__________(填字母序号)
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因_______________。
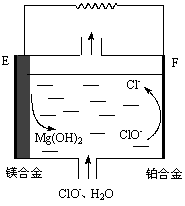
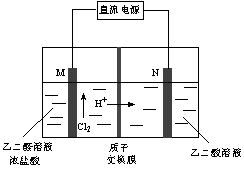
图2 图3
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的_____________极(填“正”或“负”)。F电极上的电极反应式为_____________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因____________。
(3)乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图3所示,该装置中阴、阳两极为惰性电极,两级室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为______________。
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为________________mol。
有以下物质:①HF ②Cl2 ③H2O ④N2 ⑤C2H4 ⑥C2H6 ⑦H2 ⑧H2O2 ⑨H-C≡N
(1)只含有极性键的是 ;只含有非极性键的是 ;既含有极性键又含有非极性键的是 。
(2)只含有σ键的是 ;即含有σ键又含有π键的是 ;含有由两个原子的s轨道重叠形成的σ键的是 ;
在a、b两支试管中,分别装入足量Na2CO3粉末,然后向两支试管中分别加入相同物质的量浓度、相同体积的稀盐酸和稀醋酸。填写下列空白。
(1)a、b两支试管中的现象:相同点是__________,不同点是__________________。原因是__________________。
(2)a、b两支试管中生成气体的速率开始时是a__________b,反应完毕后生成气体的总体积是a__________b,原因是__________________。
(1)在其他条件不变的情况下,研究改变起始氢气物质的量[用n(H2)表示]
对N2(g)+3H2(g) 2NH3(g)反应的影响且△H<0,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响且△H<0,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量): 
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是__________。
②若容器容积为1L,n=3mol,反应达到平衡时N2、H2的转化率均为60%,则在起始时体系中加入N2的物质的量为__________mol,NH3体积分数为_________,此条件下(T2),反应的平衡常数K=_________,当温度升高时该平衡常数将__________。
③图像中T2和T1的关系是__________。(填“高于”、“低于”、“等于”、“无法确定”)。
(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):
4NH3+5O2 4NO+6H2O ,4NH3+3O2
4NO+6H2O ,4NH3+3O2 2N2+6H2O温度较低时以生成__________为主,温度高于900℃时,NO产率下降的原因是
2N2+6H2O温度较低时以生成__________为主,温度高于900℃时,NO产率下降的原因是
已知反应①Fe(s)+CO2(g)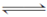 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)===CO2(g) ΔH=b kJ·mol-1;测得在不同温度下,K值如下:
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)===CO2(g) ΔH=b kJ·mol-1;测得在不同温度下,K值如下:
| 温度/℃ |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2. 40 |
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,平衡时,CO的浓度为________。
(2)反应①为________(选填“吸热”或“放热”)反应。
(3)700 ℃时反应①达到平衡,要使该平衡向右移动且能增大CO2(g)的转化率,其他条件不变时,可以采取的措施有________(填序号)。
A.缩小反应器体积 B.通入CO2 C.升高温度到900 ℃
D.使用合适的催化剂 E.增加Fe的量
(4)下列能说明反应②达到平衡状态的是________。
a.每消耗1 molCO的同时生成1 mol CO2 b.体系压强保持不变
c.v正(O2)=v逆(CO2) d.容器中混合气体的密度保持不变
e.混合气体中CO的体积分数保持不变 f.CO和O2的体积比保持不变
在一个密闭容器中,发生下列反应:C(s)+H2O(g) 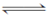 CO(g)+H2(g) ΔH>0,达到平衡后,试回答下列问题
CO(g)+H2(g) ΔH>0,达到平衡后,试回答下列问题
(1)上述正向反应是:反应(填:放热、吸热)。
(2)该反应的化学平衡常数表达式为K=。
(3)恒温恒容通人H2O(g),原化学平衡向反应方向移动(填“正移”、“逆移”“不移”下同)c(CO)____(填“增大”、“减小”或“不变” 下同)。
(4)减小密闭容器的容积,保持温度不变,原化学平衡向反应方向移动,v(正) 。
(5)某温度下上述反应平衡时,恒容、降低温度,原化学平衡向反应方向移动,容器内混合气体的压强。