(12分) Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
Q、R、X、Y、Z五种元素的原子序数依次递增。已知: ①Z的原子序数为29,其余的均为短周期主族元素;
①Z的原子序数为29,其余的均为短周期主族元素; ②Y原子价电子(外围电子)排布msnmpn
②Y原子价电子(外围电子)排布msnmpn  ③R原子核外L层电子数为奇数;
③R原子核外L层电子数为奇数; ④Q、X原子p轨道的电子数分别为2和4。
④Q、X原子p轨道的电子数分别为2和4。 请回答下列问题:
请回答下列问题: (1)基态原子Z的电子排布式是 。
(1)基态原子Z的电子排布式是 。 (2)在[Z(NH3)4]2+离子中, NH3提供 。
(2)在[Z(NH3)4]2+离子中, NH3提供 。 (3)QX2的电子式 ,一种由X和R组成的化合物与QX2互为等电子体,其化学式为 。
(3)QX2的电子式 ,一种由X和R组成的化合物与QX2互为等电子体,其化学式为 。
(4) 比较X的氢化物与同主族相邻元素所形成的氢化物稳定性 ,(填化学式),并说明理由 。
比较X的氢化物与同主族相邻元素所形成的氢化物稳定性 ,(填化学式),并说明理由 。
分碳和氮的许多化合物在工农业生产和生活中有重要的作用。
(1)工业上生产硝酸所需要的一氧化氮常用氨气来制备,该反应的化学方程式为 。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2 NH4(s)△H="-l59.5" kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H="+116.5" kJ·mol-1
③H2O(1)=H2O(g)△H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
(3)以氨气代替氢气研发氨燃料电池是当前科研的一个热点,已知氨燃料电池使用的电解质溶液是2mol·L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为;每消耗3.4g NH3转移的电子数为(阿伏加德罗常数的值用NA表示)。
(4)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g)△H="Q" kJ·mol-1。
N2(g)+CO2(g)△H="Q" kJ·mol-1。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(Min) 浓度(mol·L-1) |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.58 |
0.40 |
0.40 |
0.48 |
0.48 |
| N2 |
0 |
0.21 |
0.30 |
0.30 |
0.36 |
0.36 |
| CO2 |
0 |
0.21 |
0.30 |
0.30 |
0.36 |
0.36 |
①T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母编号)。
a.加入一定量的活性炭 b.通人一定量的NO
c.适当缩小容器的体积d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则Q 0(填“>”或“<”)。
分I:化学是一门以实验为主的科学,化学实验是学习探究物质性质的基本方法之一。(1)化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是
| A.定性检验SO32-,可用HNO3酸化的BaCl2溶液 |
| B.配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度 |
| C.检验某溶液中是否含Cl-,用HNO3酸化的AgNO3溶液 |
| D.酸性高锰酸钾溶液经常用盐酸酸化 |
(2)下列有关说法中正确的有
①用pH试纸测得氯水的pH为3.5
②用瓷坩埚高温熔融NaOH固体
③加入浓NaOH溶液,加热产生使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定含有NH4+
④向溶液中加入少量双氧水,再加几滴KSCN溶液后溶液变红,则原溶液中一定含有Fe2+
⑤实验时不慎被玻璃划破手指,引起轻微流血时,可用三氯化铁溶液涂抹止血
II:(1)某温度下,纯水中c(H+)=2.0×10-7mol·L-1.该温度下,0.9mol·L-1NaOH溶液与0.1mol·L-1 HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH= 。
(2)向含有0.020 molCH3COOH的溶液中加入0.020mol CH3COONa固体,溶液pH增大,主要原因是;已知该混合溶液中c(Na+)<c(CH3COO-),则c(CH3COOH)c(CH3COO-)(用“>”、“<”、“=”符号填空)。
(3)常温下,向100 mL 0.01mol·L-1HA溶液逐滴加入0.02mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。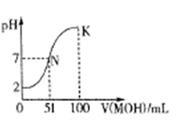
回答下列问题:
①由图中信息可知HA为酸(填“强”或“弱”)。
②K点对应的溶液中,c(M+)+c(MOH)=mol·L-1。
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知反应 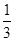 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
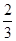 Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1. 0mol,反应经过l0min后达到平衡。
(1)CO的平衡转化率=____________
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+ 2H2(g) CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题: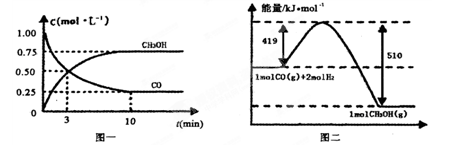
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 |
反应物投入的量 |
反应物的 转化率 |
CH3OH的浓度 |
能量变化 (Q1、Q2、Q3均大于0) |
| 甲 |
1mol CO和2mol H2 |
α1 |
c1 |
放出Q1kJ热量 |
| 乙 |
1mol CH3OH |
α2 |
c2 |
吸收Q2kJ热量 |
| 丙 |
2mol CO和4mol H2 |
α3 |
c3 |
放出Q3kJ热量 |
则下列关系正确的是________
A.c1=c2B.2Q1=Q3C.2α1=α3D.α1+α2 =1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题: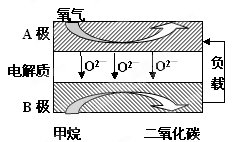
(1)B极上的电极反应式为
(2)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为(标况下)。
A、B、C、D、E、F均为短周期元素,原子序数依次递增。A元素原子核内无中子。B元素原子最外层电子数是次外层电子数的2倍。C元素是地壳是含量最多的元素。D是短周期元素中金属性最强的元素。E与F的位置相邻,F的最高价氧化物的水化物为最强的酸。
(1)推断B在元素周期表中的位置:。
(2)写出A与C形成的10电子的阳离子化学式:。(用对应的化学符号填空,下同)
(3)E、F两种元素中非金属性较强的是;用电子式表示D2C形成过程
(4)D、E形成的正盐的水溶液中,阴离子的浓度大小顺序为:(从大到小排列)。
(5)常温下,1molA元素的单质与C元素的单质化合,放出286kJ的热量,写出反应的热化学方程式:
(6)甲是A和C按原子个数比1:1组成的化合物。已知甲的溶液能使酸性高锰酸钾溶液褪色。将含有0.5mol甲的溶液滴加到100mL 2mol/L酸性高锰酸钾溶液中,溶液紫色恰好褪去,该反应的离子方程式为
下图中A~G是化合物,H是一种无色气态单质,D高温下是气体,而常温下是一种无色液体, E为淡黄色的固体。它们之间有如下转化关系: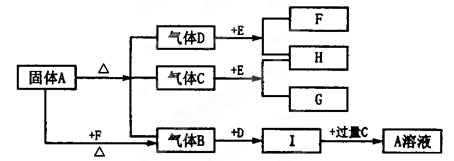
(1)写出A的化学式;C的结构式;
(2)A溶液与过量F溶液反应的离子方程式