在一固定容积的密闭容器中,保持一定条件下进行以下反应: ,已知加入1 molA和3molB。达到平衡后,生成 W mol C。
,已知加入1 molA和3molB。达到平衡后,生成 W mol C。
(1)在相同实验条件下,若在原平衡的基础上,向容器中再加入1 mol A和3 mol B,达到平衡后,C的物质的量为 mol。
(2)在相同实验条件下,若在同一容器中改为加入1.5 mol A、6.0 mol B、x mol C和足量的D,若要求在反应混合气体中C体积分数不变,计算x的值为 。
(3)在相同实验条件下,若在同一容器中改为加入0.8 mol A、a mol B、b mol C和足量的D,若要使平衡时C为1.2W mol,则a= ,b= 。
(12分)在Na+浓度为0.5 mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子。
| 阳离子 |
K+Ag+Mg2+Ba2+ |
| 阴离子 |
NO CO CO SiO SiO SO SO |
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀盐酸 |
产生白色沉淀并放出标准状况下0.56 L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为2.4 g |
| Ⅲ |
向Ⅱ的滤液中滴加BaCl2溶液 |
无明显现象 |
请回答下列问题。
(1)实验Ⅰ能确定一定不存在的离子是________________________。
(2)实验Ⅰ中与足量盐酸反应产生气体的阴离子,与少量盐酸也能反应,写出与少量盐酸反应的离子方程式为_______________________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)。
| 阴离子 |
NO |
CO |
SiO |
SO |
| c/mol·L-1 |
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:_____________________。
(共10分)向200 mL ,某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7。
(1)此时溶液的溶质如果是单一成分,可能是____________________;如果是多种成分,可能是__________________________。
(2)在上述所得溶液中,逐滴缓慢滴加2 mol·L-1的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示:
①加入盐酸200 mL之前,无气体产生,写出OA段发生反应的离子方程式___________________________________________________________________。
②B点时,反应所得溶液中溶质的物质的量浓度是__________(溶液体积的变化忽略不计)。
B. [实验化学]
某化学小组设计以下实验步骤与操作来定性检验茶叶中含有的少量钙、铁、铝三种元素。
已知Ca2+、Al3+、Fe3+完全形成相应氢氧化物沉淀的pH如下表: 
| Ca(OH)2 |
Al(OH)3 |
Fe(OH)3 |
|
| pH |
≥13 |
≥5.2 |
≥4.1 |
(1)步骤①中加入盐酸的作用是
(2)步骤②中调节pH至6~7的目的是
(3)沉淀X所含主要物质的化学式为
(4)写出步骤③中发生反应的离子方程式
(5)试剂A为;试剂B为铝试剂,加入该试剂后的实验现象是
(12 分)【选做题】本题包括A、B 两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按 A 小题评分。
A. [物质结构与性质]
由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、 H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星。
(1)写出Fe原子的价层电子排布式
(2)溶液中CH3COOH分子和NH3分子之间能不能形成稳定的氢键?
(3)CO2分子中碳原子的杂化轨道类型是;1 mol CH3COOH中含有的σ键的数目为
(4)TiO2的天然晶体中,最稳定的一种晶体结构如下图,黑球表示原子。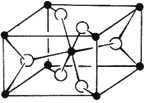
(5)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基离子结合形成的小分子化合物,该化合物中Fe2+与环戊二烯基离子之间以(填“离子键”、“金属键”、“配位键”、“氢键”、“范德华力”)相结合。
(14分)数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果。
已知:C(s)+O2(g)=CO2(g);ΔH=-393 kJ·mol-1①
2CO (g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1②
2H2(g)+O2(g)=2H2O(g);ΔH=-484 kJ·mol-1③
(1)工业上常采用将水蒸气喷到灼热的炭层上实现煤的气化(制得CO、H2),该反应的热化学方程式是
(2)上述煤气化过程中需向炭层交替喷入空气和水蒸气,喷入空气的目的是
;该气化气可在适当温度和催化剂下合成液体燃料甲醇,该反应方程式为
(3)CO常用于工业冶炼金属,下图是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。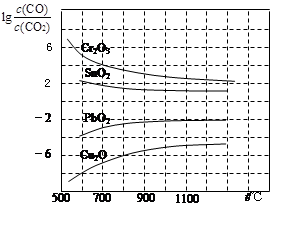
下列说法正确的是
| A.工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量 |
| B.CO不适宜用于工业冶炼金属铬(Cr) |
| C.工业冶炼金属铜(Cu)时较低的温度有利于提高CO的利用率 |
| D.CO还原PbO2的反应ΔH>0 |
(4)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2 2CO+O2,则其阳极的电极反应式为
2CO+O2,则其阳极的电极反应式为
(5)将CO通入银氨溶液中可析出黑色的金属颗粒,写出反应方程式