A、D、E、M、L是原子序数依次增大的五种短周期元素。已知A是元素周期表中原子半径最小的元素;D的某种单质是天然存在的最硬物质;E是地壳中含量最多的元素;M与A位于同一主族;L与M能够形成ML型离子化合物。回答下列问题:
(1)元素D在元素周期表中的位置是 。
(2)L的单质与M的最高价氧化物对应水化物反应的离子方程式为 。
(3)由A、D组成的最简单化合物甲的二氯化物有 种。人们已经研究出以甲为燃料的新型碱性燃料电池,写出该电池正极的电极反应式为: 。
(4)已知反应:DE(g)+A2E(g) DE2(
DE2( g)+A2(g),
g)+A2(g),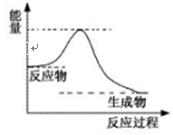
一定条件下该反应进行过程中的能量变 化如上图表示,请结合上图判断:该反应△H 0(填“>”、“<”或“=”)。该反应的平衡常数表达式为:K=
化如上图表示,请结合上图判断:该反应△H 0(填“>”、“<”或“=”)。该反应的平衡常数表达式为:K=  。
。
(5)25℃时,物质的量浓度相同的MEA、MADE3、MLE三种溶液,水的电离程度由大到小的顺序为 。
蓝铜矿主要含xCuCO3·yCu(OH)2,还含有少量Fe的化合物,工业上以蓝铜矿为原料制备Cu、CaCO3和CuSO4.5H2O。具体方法步骤如下: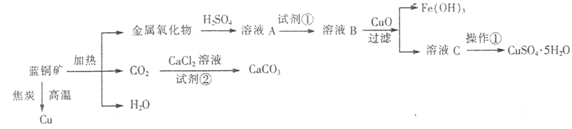
已知:
| 金属离子 |
Fe3+ |
Fe2+ |
Cu2+ |
|
| pH |
氢氧化物开始沉淀 |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀 |
3.2 |
9.0 |
6.7 |
|
(1)蓝铜矿的主要成分与焦炭高温条件可以生成铜、二氧化碳和水,写出该反应的化学方程式 。
(2)从下列所给试剂中选择:实验步骤中试剂①为 (填代号)。
a.KMnO4b.K2Cr2O7c.H2O2d.氯水
(3)在溶液B中加入CuO的作用是调节溶液pH,则pH的范围为 。
(4)由溶液C获得CuSO4.5H2O,需要经过加热蒸发浓缩、冷却结晶、过滤等操作,加热蒸发至 时停止加热。
(5)制备CaCO3时,应向CaCl2溶液中先通人(或加入)试剂②,则试剂②可以是 (填代号);
a.氨水 b.盐酸 c.水蒸气 d.NaOH溶液
如果不加人试剂②,则CaCl2溶液不能与CO2反应生成CaCO3,请依据难溶电解质的沉淀溶解平衡原理分析可能的原因 。
(6)为确定试剂①的用量,需测定溶液A中Fe2+的浓度。实验操作为:准确量取20.00mL 溶液A于锥形瓶中,用0.01200 mol/L的酸性KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液15.00 mL,则溶液A中Fe2+的浓度为 。
汽车尾气中的NOx是大气污染物之一,科学家们在尝试用更科学的方法将NOx转化成无毒物质,从而减少汽车尾气污染。
(1)压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO2(g)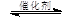 4NO(g)+CO2(g)+2H2O(g)△H1<0
4NO(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+4NO(g)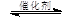 2N2(g)+CO2(g)+2H2O(g)△H2<0
2N2(g)+CO2(g)+2H2O(g)△H2<0
③CH4(g) +2NO2(g)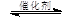 N2(g) +CO2(g) +2H2O(g)△H3= 。(用△H1和△H2表示)
N2(g) +CO2(g) +2H2O(g)△H3= 。(用△H1和△H2表示)
(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应③,在不同温度、不同投料比时,NO2的平衡转化率见下表:
| 投料比[n(NO2) / n(CH4)] |
400 K |
500 K |
600 K |
| 1 |
60% |
43% |
28% |
| 2 |
45% |
33% |
20% |
①写出该反应平衡常数的表达式K= 。
②若温度不变,提高[n(NO2) / n(CH4)]投料比,则K将 。(填“增大”、“减小”或“不变”。)
③400 K时,将投料比为1的NO2和CH4的混合气体共0.04 mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数 。
(3)连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示意图如图1
①NiO电极上NO发生的电极反应式: 。
②收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,
则尾气中V(NO)︰V(NO2)=
(4)在容积相同的两个密闭容器内(装有等量的某种催化剂)先各通入等量的CH4,然后再分别充入等量的NO和NO2。在不同温度下,同时分别发生②③两个反应:并在t秒时测定其中NOx转化率,绘得图象如图2所示:
①从图中可以得出的结论是
结论一:相同温度下NO转化效率比NO2的低
结论二:在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小
结论二的原因是
②在上述NO2和CH4反应中,提高NO2转化率的措施有_________。(填编号)
A.改用高效催化剂
B.降低温度
C.分离出H2O(g)
D.增大压强
E.增加原催化剂的表面积
F.减小投料比[n(NO2) / n(CH4)]
(15分)由香兰素制取多巴胺的,合成过程如下: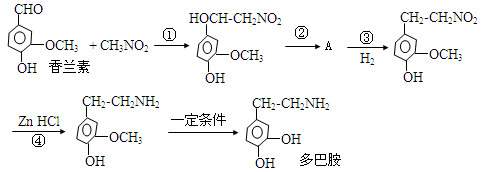
请回答下列问题:
(1)香兰素除了醛基之外,还含有官能团的名称是 。
(2)多巴胺的分子式是 。
(3)上述合成过程中属于加成反应类型的是: (填反应序号)。
(4)写出符合下列条件的多巴胺的其中一种同分异构体的结构简式:
①属于1,3,5-三取代苯;②苯环上直接连有一个羟基和一个氨基;③分别能与钠和氢氧化钠反应,消耗钠与氢氧化钠的物质的量之比为2∶1
________________________
(5)请写出有机物A与足量浓溴水反应的化学方程式
___________________________________________________________________________
(6)苯乙胺(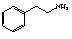 )是生物体中重要的生物碱。写出用苯甲醇、硝基甲烷为原料制备苯乙胺的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
)是生物体中重要的生物碱。写出用苯甲醇、硝基甲烷为原料制备苯乙胺的合成路线流程图(无机试剂任选)。合成路线流程图示例如下: 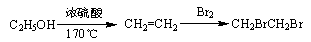
在3种有机物 ① CH4、② CH2=CH2、③ CH3COOH中,属于食醋的主要成分是 (填序号,下同),属于沼气的主要成分是____,可作为植物生长调节剂的是 。
电极a、b分别为Ag电极和Pt电极,电极c、 d都 是 石墨电极。通电一段时间后,b电极上有固体析出,在c、d两极上共收集到336mL(标准状态)气体。回答: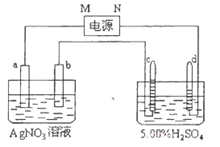
(1)直流电源中,M为______________极。
(2)Pt电极上生成的物质是____________,其质量为____________g 。
(3)电子转移的物质的量与电极b、c、d分别生成的物质的物质的量之比为________。
(4)电解过程中,AgNO3溶液的浓度______________(填“增大”、“减小”或“不变”,
下同),AgNO3溶液的pH__________,H2SO4溶液的浓度_________ ,H2SO4溶液的pH________ 。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为______g。