汽车尾气中的NOx是大气污染物之一,科学家们在尝试用更科学的方法将NOx转化成无毒物质,从而减少汽车尾气污染。
(1)压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO2(g)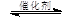 4NO(g)+CO2(g)+2H2O(g) △H1<0
4NO(g)+CO2(g)+2H2O(g) △H1<0
②CH4(g)+4NO(g)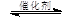 2N2(g)+CO2(g)+2H2O(g) △H2<0
2N2(g)+CO2(g)+2H2O(g) △H2<0
③CH4(g) +2NO2(g)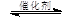 N2(g) +CO2(g) +2H2O(g) △H3= 。(用△H1和△H2表示)
N2(g) +CO2(g) +2H2O(g) △H3= 。(用△H1和△H2表示)
(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应③,在不同温度、不同投料比时,NO2的平衡转化率见下表:
| 投料比[n(NO2) / n(CH4)] |
400 K |
500 K |
600 K |
| 1 |
60% |
43% |
28% |
| 2 |
45% |
33% |
20% |
①写出该反应平衡常数的表达式K= 。
②若温度不变,提高[n(NO2) / n(CH4)]投料比,则K将 。(填“增大”、“减小”或“不变”。)
③400 K时,将投料比为1的NO2和CH4的混合气体共0.04 mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数 。
(3)连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示意图如图1

①NiO电极上NO发生的电极反应式: 。
②收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,
则尾气中V(NO)︰V(NO2)=
(4)在容积相同的两个密闭容器内(装有等量的某种催化剂)先各通入等量的CH4,然后再分别充入等量的NO和NO2。在不同温度下,同时分别发生②③两个反应:并在t秒时测定其中NOx转化率,绘得图象如图2所示:
①从图中可以得出的结论是
结论一:相同温度下NO转化效率比NO2的低
结论二:在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小
结论二的原因是
②在上述NO2和CH4反应中,提高NO2转化率的措施有_________。(填编号)
A.改用高效催化剂
B.降低温度
C.分离出H2O(g)
D.增大压强
E.增加原催化剂的表面积
F.减小投料比[n(NO2) / n(CH4)]
现有下列物质, 用编号填空回答下列各问题:
| A.干冰 | B.金刚石 | C.氩 | D.过氧化钠 E.二氧化硅 F.氯化铵 |
(1)通过非极性键形成的晶体是 。
(2)固态时属于分子晶体的是 。
(3)由原子构成的分子晶体是 。
(4)含有非极性键的离子化合物是 。
(5)含有离子键、共价键、配位键的化合物是 。
氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答: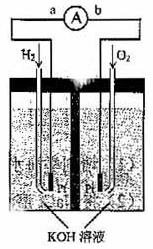
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
(用a、b表示)。(2)负极反应式为 。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2 2LiH
2LiH
Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度为 0.82g/cm3。用锂吸收 224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 。
15分)(1)下图所示的模型表示的分子中,可由碳和氢两种元素形成的是。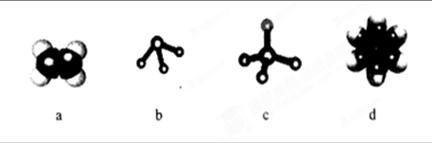
c分子的空间构型为;d分子的结构简式
(2)关于a分子有下列问题:
①如果a分子中的一个氢原子被甲基取代后得到的物质中在同一平面的原子最多有____________个。
②a能使溴的水溶液褪色,该反应的生成物的名称是。
③a与氢气发生加成反应后生成分子e,e在分子组成和结构上相似的有机物有一大类(又称“同系物”),它们均符合通式CnH2n+2,当n=_______时,这类有机物开始出现同分异构体,写出该烷烃可能有的同分异构体结构简式。
(3)苯环结构中,不存在单双键交替结构,可以作为证据的事实是:①苯不能使KMnO4(H+)溶液褪色②苯中碳碳键的键长均相等③苯能在一定条件下跟H2发生加成反应生成环己烷④经实验测得邻二甲苯仅有一种结构⑤苯在FeBr3存在的条件下同液溴可发生取代反应,但不能因化学变化而使溴水褪色。其中正确的是
(4)已知乳酸的结构简式为CH3CH(OH)COOH。试回答:
①乳酸分子中含有________和_________两种官能团(写名称);
②乳酸与金属钠反应的化学方程式为
_________________________________________________________________;
③当乳酸和浓硫酸共热时,能产生多种酯类化合物,写出乳酸在一定条件下合成聚酯的化学方程式_________________________________________________________________
下表是元素周期表的一部分,回答下列有关问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
||||
| 2 |
① |
② |
||||||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|||||
| 4 |
⑩ |

|
|
⑴.在这些元素的最高价氧化物对应水化物中,酸性最强的是(填化学式,下同) ,碱性最强的是 ,呈两性的氢氧化物是 ,
⑵.写出工业上冶炼⑤的化学方程式为 ;⑤与一种黑色晶体反应冶炼铁的化学方程式为: 。
⑶.在⑧与⑦中,非金属性较强的元素是 ,写出可以验证该结论的一个离子反应方程式 。
分别取40mL的0.50 mol/L盐酸与40mL的0.55 mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)理论上稀强酸、稀强碱反应生成1 mol 水时放出57.3 kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式__________________________________。
(2)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其原因是_____________________________________________;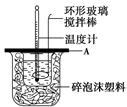
(3)假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g·℃)。为了计算中和热,实验时还需测量的数据有(填序号)________。
| A.反应前盐酸溶液的温度 |
| B.反应前盐酸溶液的质量 |
| C.反应前氢氧化钠溶液的温度 |
| D.反应前氢氧化钠溶液的质量 |
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
| 实验 序号 |
起始温度t1/℃ |
终止温度t2/℃ |
|
| 盐酸 |
氢氧化钠 |
混合溶液 |
|
| 1 |
20.0 |
20.1 |
23.2 |
| 2 |
20.2 |
20.4 |
23.4 |
| 3 |
20.5 |
20.6 |
23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________;