A是单质,D是A单质所含元素的最高价氧化物的水化物,甲、乙、丙、丁四种化合物间除甲与丁、丙与乙外,两两均能发生中和反应。已知有如下转化关系(部分产物和反应条件已略去);
试回答:
(1) 写出B在工业生产中的一种用途 。
(2)写出B转化为C的可能的离子方程式 。
(3)若C的溶液显酸性,用离子方程式表示其净水的原理 。
(4)若C为钠盐,用含m mol C的溶液与1L n mol·L-1的盐酸充分反应,已知m/n=1/2,则生成D的物质的量为 mol。
(5)用A单质和铂作电极,与海水、空气组成海洋电池,写出铂电极上发生反应的电极反应式 ;若负极材料消耗18g,则电池转移的电子总数为 。 (阿伏加德罗常数用NA表示)
氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高.
(1)若电解质溶液为KOH溶液,其正极反应为,负极反应为﹣;
(2)若电解质溶液为硫酸,其正极反应为,负极反应为;若反应过程中转移了2mol电子,可产生水的质量为g.
(3)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=0.3mol•L﹣1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体.此时氢氧燃料电池外电路中转移电子数为,消耗H2的质量为g.
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).
(1)丙烷脱氢可得丙烯. 已知:C3H8(g)═CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ•mol﹣1
CH3CH=CH2(g)═CH4(g)+HC≡CH(g)△H2=32.4kJ•mol﹣1则相同条件下,反应C3H8(g)═CH3CH=CH2(g)+H2(g)的△H=kJ•mol﹣1
(2)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ•mol﹣1CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4kJ•mol﹣1
2H2S(g)=2H2(g)+S2(g)△H=+169.8kJ•mol﹣1以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为.
(3)铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛.真空碳热还原﹣氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g)△H="a" kJ•mol﹣13AlCl(g)=3Al(l)+AlCl3(g)△H="b" kJ•mol﹣1反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=kJ•mol﹣1(用含a、b的代数式表示).
(1)下列各种情况,在其中Fe片腐蚀由快到慢的顺序是.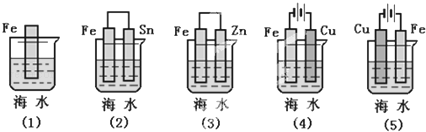
(2)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度不大的环境中负极反应式为;正极反应式为.
完成下列计算
(1) 相同物质的量的O2和O3的质量比____,分子个数比为______,所含氧原子的个数比为_______.
(2) 在200 mL 2 mol/L MgCl2溶液中,溶质的质量为________.此溶液中Mg2+的物质的量浓度为___________,Cl-的物质的量浓度为________.
(3) 在质量分数为28%的KOH水溶液中,OH-与H2O数目之比是________.
(1)某温度下,纯水中的c(H+)=2.0×10—7mol/L,此时溶液的c(OH—)=mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10—4mol/L,则溶液中c(OH—)=mol/L,由水电离产生的c(H+)=mol/L,此时温度25℃(填“高于”、“低于”或“等于”)。
(2)室温时,将pH=5的H2SO4稀释10倍,则c(H+)∶c(SO42—)=,将稀释后的溶液再稀释1000倍,则c(H+)∶ c(SO42—)=。
(3)有稀硫酸和稀盐酸的混合溶液20ml,向此溶液中滴加0.025mol/LBa(OH)2溶液时,生成沉淀的质量和溶液pH的变化情况如图所示,求: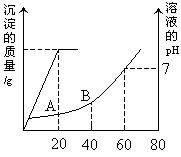
⑴原混合溶液中硫酸和盐酸的物质的量浓度?
⑵滴到A、B两点时溶液的pH 各是多少?