某化学小组采用如图装置,以冰醋酸和异戊醇制备少量乙酸异戊酯(俗称:香蕉水)。
已知:CH3COOH+HOCH2CH2CH(CH3)2  CH3COOCH2CH2CH(CH3)2+H2O
CH3COOCH2CH2CH(CH3)2+H2O
| |
密度(g/m L) L) |
熔点(℃) |
沸点(℃) |
溶解性 |
| 冰醋酸 |
1.049 |
16.6 |
118.1 |
能溶于水 |
| 异戊醇 |
0.812 |
-117.2℃ |
130.5 |
微溶于水 |
| 乙酸异戊酯 |
0.869 |
-78℃ |
140 |
难溶于水 |
实验步骤:
(1)制备粗品
在50mL干燥的 中(填仪器名称)加入10mL(8.1g , 0.092mol)异戊醇和10mL(10.5g , 0.175mol)冰醋酸,振摇下缓缓加入2.5mL浓硫酸并使其混合均匀,再投入几块碎瓷片,装上冷凝管,冷却水从_________口进入,控制温度100℃左右,加热回流至锥形瓶中液体无明显增加为止。
A中碎瓷片的作用是
锥形瓶中的液体主要是 ,采用边反应边将其蒸出的方法的目的是 。
(2)制备精品
①反应结束后,冷却反应物至室温。将装置A中的反应混合物倒入分液漏斗中,用少量饱和食盐水荡洗反应瓶,一起并入分液漏斗。用饱和食盐水代替蒸馏水的优点是 。
②振摇分液漏斗,静置分层后分去水层。有机层先用25 mL 10% 碳酸钠水溶液洗涤除去 杂质 ,再用水洗涤两次。分尽水层后将酯层转入干燥的锥形瓶中,用 (填写选项)干燥0.5h。
a.五氧化二磷 b.碱石灰 c.无水硫酸镁 d.生石灰
③将干燥后的液体过滤到装置A中,加热蒸馏收集 ℃的馏分,称重,产物重8.4g,则该实验的产率为 。(保留两位有效数字)
已知常温下,氨水中NH3·H2O的电离平衡常数:K=1.6×10-5;若NH3·H2O的起始浓度为1mol·L-;则平衡时c(OH-)=
下列各物质的溶液物质的量浓度均为0.1 mol·L-1
①HCl ②NaOH ③ Na2CO3④CH3COONa ⑤NH4Cl ⑥Ba(OH)2⑦KCl ⑧ CH3COOH
按它们的pH由小到大的排列的顺序为(填序号)
物质A~G有下图所示转化关系(部分反应物、生成物没有列出)。其中A为某金属矿的主要成分,经过一系列反应可得到B和C。单质C可与E的浓溶液发生反应,G为砖红色沉淀。(提示:葡萄糖结构简式为CH2OH(CHOH)4CHO )
请回答下列问题:
(1)写出下列物质的化学式:B、E、G
(2)利用电解精炼法可提纯C物质,在该电解反应中阳极电极材料是,阴极电极材料是,电解质溶液是
(3)反应②的化学方程式是。
(4)将0.23 mol B和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12 mol D,则反应的平衡常数K =(保留一位小数)若温度不变,再加入0.50 mol氧气后重新达到平衡,则:
B的平衡浓度(填“增大”、“不变”或“减小”),
氧气的转化率(填“升高”、“不变”或“降低”),
D的体积分数(填“增大”、“不变”或“减小”)。
(19分)
Ⅰ:现有CH4、C2H4、C2H2、C2H6、C3H8五种有机物,回答下列问题:
⑴质量相同时:在相同状况下体积最大的是__ ____,完全燃烧时消耗O2的量最多的是__ __,生成CO2最多的是___ _,生成水最多的是___ ___。
⑵同温同压同体积时,五种物质完全燃烧消耗O2的量最多的是__
Ⅱ:有机化学中的反应类型较多,将下列反应归类(填序号)。
①乙苯的制备: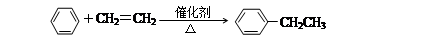
②乙烷在空气中燃烧③乙烯使溴的四氯化碳溶液褪色④乙烯使酸性高锰酸钾溶液褪色⑤由乙烯制聚乙烯⑥甲烷与氯气在光照的条件下反应⑦溴乙烷和氢氧化钠的乙醇溶液共热⑧由甲苯制取TNT
(1)其中属于取代反应的是;
属于氧化反应的是;属于加成反应的是;
属消去反应的是属于聚合反应的是
(2)写出⑦和⑧的化学方程式
⑦
⑧
Ⅲ:医药阿斯匹林的结构简式如图1所示: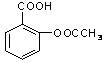
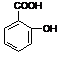
图1图2
试根据阿斯匹林的结构回答;
⑴阿斯匹林看成酯类物质,口服后,在胃肠酶的作用下,阿斯匹林发生水解反应,生成A和B 两种物质。其中A的结构简式如图2所示,则B的结构简式为;B中含有的官能团名称是。
⑵阿斯匹林跟NaHCO3同时服用,可使上述水解产物A与NaHCO3反应,生成可溶性盐随尿液排出,此可溶性盐的结构简式是
⑶写出阿斯匹林与足量氢氧化钠溶液共热的化学反应方程式
⑴某化学兴趣小组对“农夫山泉”矿泉水进行检测时,发现1.0 L该矿泉水中含有45.6 mg Mg2+的物质的量浓度为____________________。(提示:1g=1000mg)
⑵在KCL和CaCL2所组成的某混合物中,K+与Ca2+的物质的量之比为2:1,则KCL与CaCL2的物质的量之比为____________,该混合物中的CaCL2的质量分数为___________。