(6分) 在H2、NH4Cl、SiC、CO2、HF中,由极性键形成的非极性分子有(1)________,由非极性键形成的非极性分子有(2)________,能形成分子晶体的物质是(3)________,含有氢键的晶体的化学式是(4)________,属于离子晶体的是(5)________,属于原子晶体的是(6)________。
红磷P(s)和Cl2(g)发生反应生成 PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。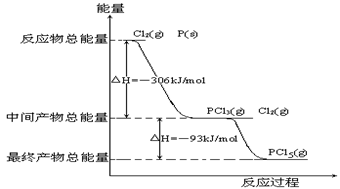
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式______________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式_____________________
(3)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)。
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知H 2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知N2(g)+2O2(g)="===2" NO2(g);△H="+67.7" kJ·mol-1, N2H4(g)+O2(g)="==" N2(g)+2H2O (g);△H=—534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式_____________________。
已知下列反应的焓变
(1)CH3COOH(l)+2O2(g)==2CO2(g)+2H2O(l) △H1="-870.3kJ/mol"
(2)C(s)+O2(g) = =CO2(g)△H2=-393.5kJ/mol
=CO2(g)△H2=-393.5kJ/mol
(3) 2 H2(g)+O2(g) ==2H2O(l)△H3= -285.8kJ/mol 试计算反应2C(s)+2H2(g)+O2(g) ==CH3COOH(l)的焓变ΔH=
试计算反应2C(s)+2H2(g)+O2(g) ==CH3COOH(l)的焓变ΔH=
工业制氢气的一个重要反应是:CO(s)+ H2O(g) ="=" CO2(g) + H2(g)
已知25℃时:C(石墨) +O2 (g) ==CO2(g)△H1 =-394 kJ·mol-1
C(石墨) +1/2O2 (g) ==CO (g)△H2 =-111 kJ·mol-1
H2(g) +1/2O2 (g)==H2O(g)△H3=-242kJ·mol-1
试计算25℃时CO(s)+ H2O(g) ="=" CO2(g) + H2(g)的反应热_______ kJ·mol-1
写出298K时,下列反应的热化学方程式
(1)28 g CO还原Fe2O3生成单质铁,放出8.3 kJ热量;
(2)N2和O2化合生成184 g NO2气体,吸收热量135.4 kJ;