乙烷受热分解生成乙烯和氢气,现有乙烷部分分解的产物,取1体使其充分燃烧生成1.6体积的二氧化碳气体(在相同条件下测定),则乙烷的分解率为
| A.20% | B.25% | C.50% | D.75% |
用足量盐酸处理1.68 g某合金,放出448 mL H2(标准状况下),有0.56 g不溶物;用足量NaOH溶液处理该合金时放出896 mL H2(标准状况下),有1.12 g不溶物。则该合金的组成可能是()
| A.Al、Fe | B.Fe、Si | C.Al、Si | D.Zn、Fe |
V L Fe2(SO4)3溶液中含有agSO42-,取此溶液0.5V L,用水稀释至2V L,稀释后溶液中Fe3+的物质的量的浓度为
A. mol/L mol/L |
B. mol/L mol/L |
C. mol/L mol/L |
D.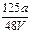 mol/L mol/L |
能正确表示下列反应离子方程式的是()
| A.过氧化钠固体与水反应:2O22—+2H2O ="=" 4OH-+O2↑ |
| B.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全: 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| C.向硫酸铜溶液中加入足量的氢氧化钡溶液:Ba2+十SO42-=BaSO4↓ |
| D.向碳酸氢钠液中滴入过量石灰水:HCO3-+Ca2+十OH-=CaCO3↓+H2O |
有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl―完全沉淀,反应中消耗x molH2SO4 ,y molAgNO3。则原溶液中的钠离子浓度为()
| A.(y -2 x)/a | B.(y–x)/a | C.(2y -2 x)/a | D.(2y -4x)/a |
在两个密闭容器中,分别充有质量相等的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是()
| A.甲的分子数比乙的分子数多 |
| B.甲的物质的量比乙的物质的量少 |
| C.甲的气体摩尔体积比乙的气体摩尔体积小 |
| D.甲的相对分子质量比乙的相对分子质量少 |