A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B ,C ,D ,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:
。
(3)写出A、B两元素的最高价氧化物的水化物相互反应的化学方程式:
。
下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
| A |
B |
|||||||
| C |
D |
E |
F |
G] |
(1)画出G的原子结构示意图___________________
(2)A、B、C、E、F五种元素的原子半径最大的是___________(填化学式)
(3)E、F、G元素的最高价氧化物对应水化物的酸性较弱的是_____________(用化学式表示)
(4)写出C和F形成化合物的电子式______________________
(1)用盐酸可以除去铜器表面的铜绿,该反应的化学方程式为:
____________________
(2)写出苯发生硝化反应的化学方程式:
___________________________________________________________________
布噁布洛芬是一种消炎镇痛的药物。它的工业合成路线如下:
请回答下列问题:
⑴A长期暴露在空气中会变质,其原因是。
⑵有A到B的反应通常在低温时进行。温度升高时,多硝基取代副产物会增多。下列二硝基取代物中,最可能生成的是。(填字母)
a. b.
b.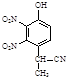 c.
c. d.
d.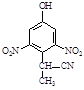
⑶在E的下列同分异构体中,含有手性碳原子的分子是。(填字母)
a.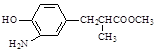 b.
b.
c. d.
d.
⑷F的结构简式。
⑸D的同分异构体H是一种α-氨基酸,H可被酸性KMnO4溶液氧化成对苯二甲酸,则H的结构简式是。高聚物L由H通过肽键连接而成,L的结构简式是。
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
⑴已知某反应的平衡表达式为:
它所对应的化学反应方程式为:
⑵利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g);ΔH=-90.8kJ·mol
CH3OH(g);ΔH=-90.8kJ·mol
②2CH3OH(g) CH3OCH3(g)+H2O(g);ΔH=-23.5kJ·mol
CH3OCH3(g)+H2O(g);ΔH=-23.5kJ·mol
③CO(g)+H2O(g) CO2(g)+H2(g);ΔH=-41.3kJ·mol
CO2(g)+H2(g);ΔH=-41.3kJ·mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH=__________
CH3OCH3(g)+CO2(g)的ΔH=__________
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
该反应的正反应方向是反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为:。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。
对反应:N2O4(g) 2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是。
2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是。
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。现在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。下列说法正确的是
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。现在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。下列说法正确的是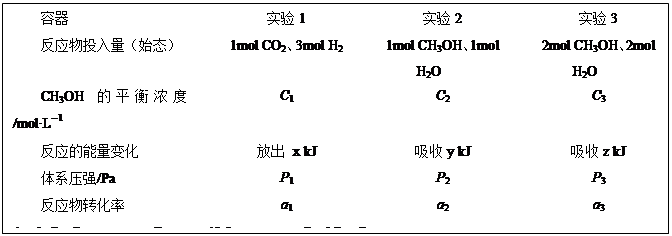
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3MgO、CaO等,生产工艺流程示意如下:
(1)将菱锌矿研磨成粉的目的是_____。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3+□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
| Mg(OH)2 |
Zn(OH)2 |
MgCO3 |
CaCO3 |
|
| 开始沉淀的pH[来源 |
10.4 |
6.4 |
— |
— |
| 沉淀完全的pH |
12.4 |
8.0 |
— |
— |
| 开始溶解的pH |
— |
10.5 |
— |
— |
| Ksp |
5.6×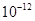 |
— |
6.8×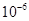 |
2.8×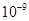 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉b.石灰乳c.纯碱溶液d.烧碱溶液
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。