A、B、C、D、E为短周期内除稀有气体外的5种元素,它们的原子序数依次增大,其中只有D为金属元 素。B原子的最外层上有4个电子,A和D的最外层电子数相等。D、E两元素原子的质子数之和为A、C两元素质子数之和的3倍。由此可知:
素。B原子的最外层上有4个电子,A和D的最外层电子数相等。D、E两元素原子的质子数之和为A、C两元素质子数之和的3倍。由此可知:
(1)写出元素符号:A为_____,B为_____ ,C为_____,D为______,E为________。
(2)由A和C形成的原子个数比为1:1的化合物的结构式为 ,
化合物D2C2的电子式为 ,该化合物中含有的化学键为
(选填离子键、极性键和非极性键)
(3)用电子式表示D2E的形成过程
(4)比较C、D、E的离子半径大小 (用离子符号表示)
(5)比较A2C和A2D的沸点 、稳定性 (用化学式表示)
(6) B的最高价氧化物与D的最高价氧化物反应可得C单质,写出反应的化学方程式

(7) 写出E的最高价氧化物对应水化物的浓溶液与B单质反应的方程式 。
(10分)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物最多的元素之一,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。
回答下列问题:
(1)写出元素名称:X、Y。
(2)Y2X2分子中Y原子轨道的杂化类型为,1mol Y2X2含有σ键的数目为。
(3)化合物ZX3中Z原子轨道的杂化类型为,ZX3的沸点比化合物YX4的高,其主要原因是。
(4)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是。
(5)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是,它可与浓盐酸发生非氧化还原反应,生成配合物H nWCl3,反应的化学方程式为。
(1)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是。
(2)H3O+的分子立体结构为 ,BCl3的构型为。
(3)已知Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一为绿色。两种晶体的组成皆为TiCl3•6H2O。为测定这两种晶体的化学式,设计了如下实验:
a. 分别取等质量的两种配合物晶体的样品配成待测溶液;
b. 分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c. 沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的 。
。
绿色晶体配合物的化学式为,由Cl所形成的化学键类型是
有X、Y、Z三种元素。其中X原子的价电子构型为2s22p2,Y原子的L电子层中有三个未成对电子,且无空轨道;Z的+1价离子是一个质子。试回答下列问题:
(1)写出Y原子价层电子排布图;
(2)ZXY分子中的三个原子除Z原子外均为8电子构型,写出该分子的结构式,根据电子云重叠方式的不同,分子里共价键的类型有;
(3)常温下,YZ3呈气态,但易被液化,且极易溶于水,其原因是;
(4)液态的YZ3是一种重要的溶剂,其性质与H2O相似,可以与活泼金属反应,写出Na与液态YZ3反应的化学方程式。
利用海水资源进行化工生产的部分工艺流程如下图所示:
(1)流程I中,欲除去粗盐中含有的Ca2+、Mg2+、SO42-等离子,需将粗盐溶解后,按序加入药品进行沉淀、过滤。其加入药品顺序合理的是。
a. Na2CO3、NaOH、BaCl2溶液 b.NaOH、BaCl2、Na2CO3溶液
c.NaOH、Na2CO3、BaCl2溶液 d.BaCl2、Na2CO3、NaOH溶液
(2)流程Ⅱ中,电解饱和NaCl溶液的离子方程式为。从原子结构角度分析阴极之所以得到H2其根本原因是。
(3)流程Ⅲ中,通过化学反应得到NaHCO3晶体。下图为NaCl、NH4Cl、NaHCO3、NH4HCO3的溶解度曲线,其中能表示NaHCO3溶解度曲线的是,化学反应方程式是。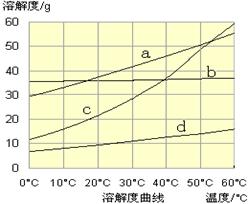
(4)流程Ⅳ中,所得纯碱常含有少量可溶性杂质,提纯它的过程如下:将碳酸钠样品加适量水溶解、 、 、过滤、洗涤2-3次,得到纯净Na2CO3•10H2O。
② 对Na2CO3•10H2O脱水得到无水碳酸钠。
已知:Na2CO3·H2O(s)=Na2CO3(s)+ H2O(g) ΔH1=" +" 58.73 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH1=" +473.63" kJ·mol-1
如把该过程中产生的气态水液化,将释放的热量反补给该生产过程所需的能耗,若不考虑能量无效损失,则理论上生产1molNa2CO3只需耗能92.36kJ,由此得出:
H2O(g) = H2O(l)△H= 。
向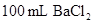 、
、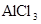 和
和 的混合溶液A中,逐滴加入
的混合溶液A中,逐滴加入 和NaOH的混合溶液B,产生的沉淀和加入溶液B的体积关系如下图所示:
和NaOH的混合溶液B,产生的沉淀和加入溶液B的体积关系如下图所示: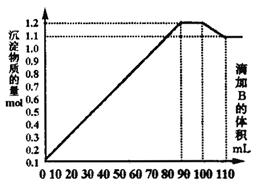
(1)当加入B溶液110 mL时,溶液中的沉淀是___________________________(填化学式).
(2)溶液B中 与NaOH的物质的量浓度之比________________;从90 mL至100 mL
与NaOH的物质的量浓度之比________________;从90 mL至100 mL
之间加入10 mL B溶液时所发生的离子反应方程式是____________________________
______________________________________.
(3)将A、B溶液中各溶质的物质的量浓度填入下表:
| 溶质 |
 |
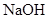 |
 |
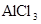 |
 |
浓度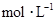 |