(16分)肉桂酸甲酯(H)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基。
又知J为肉桂酸甲酯的一种同分异构体,其分子结构模型如下图所示(图中球与球之间连线表示单键或双键)。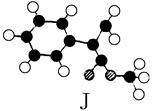
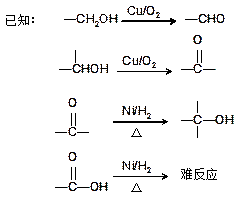
试回答下列问题。
(1)①肉桂酸甲酯(H)的结构简式为 。
②有关肉桂酸甲酯的叙述中,正确的是 (填标号)。
| A.能与溴的四氯化碳溶液发生加成反应 | B.不能使酸性高锰酸钾溶液褪色 |
| C.在碱性条件下能发生水解反应 | D.不可能发生加聚反应 |
(2)现测出A的核磁共振氢谱谱图有6个峰,其面积之比为1﹕2﹕2﹕2﹕1﹕2。
用芳香烃A 为原料合成H的路线如下: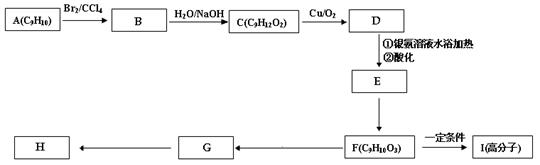
2 化合物F中的官能团有 (填名称)。
4 B→C的反应类型是 ,F→G的反应类型是 。
5 书写化学方程式
F→I
G→H
(3)写出符合下列条件的G的同分异构体的结构简式:
ⅰ.分子内含苯环,且苯环上只有一个支链;
ⅱ.一定条件下,1mol该物质与足量的银氨溶液充分反应,生成4mol银单质。
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。
⑴图中的两处明显的错误是
_____________________________________。
_____________________________________。
⑵A仪器的名称是___________,
B仪器的名称是。
⑶实验时A中除加入少量自来水外,还需加入少量,
其作用是_____。
对于混合物的分离或提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、洗气、加热分解等。下列各组混和物的分离或提纯应采用什么方法?
①实验室中的石灰水久置,液面上常悬浮有块状CaCO3。可用 的方法除去Ca(OH)2溶液中悬浮的CaCO3。
②除去H2中的CO2,可用的方法除去。
③除去乙醇中溶解的微量食盐可采用的方法。
④粗盐中含有不溶性的泥沙、可溶性的氯化钙、氯化镁及一些硫酸盐。要将粗盐提纯,可先将粗盐溶解,按一定的顺序加入沉淀剂,再;然后将滤液调成中性并就可以得到纯净的氯化钠。
⑤除去氧化钙中的碳酸钙可用的方法。
Fe、Zn、Al分别与盐酸反应(结果可用分数表示,不必化简):
(1)若盐酸足量,等物质的量的Fe、Zn、Al产生H2的质量之比为_____________。
(2)若盐酸足量,等质量的Fe、Zn、Al产生H2的质量之比为_________________, (3)若盐酸足量,等质量的Fe、Zn、Al产生H2在同温同压下的体积比为________。
某短周期元素 ,其最高价氧化物对应水化物甲与其气态氢化物乙反应可生成盐丙。己知乙的密度是同温同压下H2密度的
,其最高价氧化物对应水化物甲与其气态氢化物乙反应可生成盐丙。己知乙的密度是同温同压下H2密度的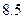 倍。请回答:
倍。请回答:
(1)乙的电子式为,结构式为 ,空间构型为。
(2)甲具有不稳定性,发生分解反应的化学反应方程式为。实验室保存甲的方法是。
(3)现有硫酸和甲的混合液20 mL,其中硫酸的物质的量浓度为2 mol/L,甲的物质的量浓度为1 mol/L。向该混合液中加入0.96 g铜粉,假设只生成一种无色气体,则所收集到气体的体积在标准状况下为mL。
已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的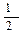 ,Y元素最高正价与它的负价代数和为6。M与其它物质的转化关系如下(部分产物已略去):
,Y元素最高正价与它的负价代数和为6。M与其它物质的转化关系如下(部分产物已略去):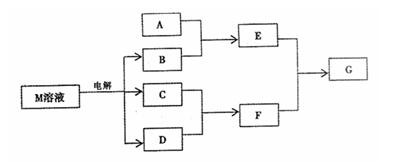
(1)若A是与X、Y同周期的一种常见金属单质,则A与B溶液反应的化学方程式是: ;
; (2)若A是一种常见酸性氧化物,且可用于制造玻璃,则E与F反应的离子方程式是:
(2)若A是一种常见酸性氧化物,且可用于制造玻璃,则E与F反应的离子方程式是: ;
; (3)若A是一个溶液,只可能含有H+、NH4+、Mg2+、Fe3+、
(3)若A是一个溶液,只可能含有H+、NH4+、Mg2+、Fe3+、 Al3+、CO32-、SO2- 中的某些离子,当向该溶液中加入
Al3+、CO32-、SO2- 中的某些离子,当向该溶液中加入 B溶液时,发现生成沉淀的物质的量随B溶液的体积
B溶液时,发现生成沉淀的物质的量随B溶液的体积 变化如图所示,由此可知该溶液中肯定含有的离子
变化如图所示,由此可知该溶液中肯定含有的离子 有。
有。