.下图是周期表中短周期的一部分,A.B.C三种元素的原子核外电子数之和等于B的质子数的2倍。
1、(用元素符号表示)A B C
2、B的最高价氧化物的化学式 ,属于 晶体。
3、C的气态氢化物的化学式 ,其中存在 键。
某含碳、氢、氧的有机物A能发生如下变化: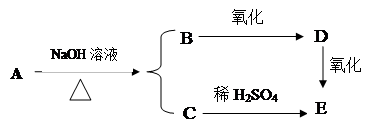
已知A、C、D、E均能发生银镜反应。试写出A、B、C、D、E的结构简式:
ABCDE
Nomex 纤维是一种新型阻燃性纤维,它可由间苯二甲酸和间苯二胺在一定条件下以等物质的量缩聚而成,请把Nomex 纤维的结构简式写在下面的方框中。

某有机物含有C、H、N、O四种元素,下图为该有机物的球棍模型。
(1)该有机物的化学式 ,结构简式
(2)该有机物可能发生的化学反应有(填编号)
①水解 ②加聚 ③取代 ④消去 ⑤酯化
(3)该有机物发生水解反应的化学方程式  (4)写出该物质的一种含有两个-CH-,且是天然蛋白质水解的最终产物的同分异构体的结构简式
(4)写出该物质的一种含有两个-CH-,且是天然蛋白质水解的最终产物的同分异构体的结构简式
有①NH2-CH2-COOH ②CH2OH(CHOH)4CHO ③(C6H10O5)n(纤维素)
④HCOOC2H5 ⑤苯酚 ⑥HCHO等物质,其中(用数字序号填空)。
(1)难溶于水的是,易溶于水的是,常温下微溶于水的是
(2)能发生银镜反应的是
(3)能发生酯化反应的是
(4)能跟氢气发生加成反应的是,能在一定条件下跟水反应的是
(5)能跟盐酸反应的是,能跟氢氧化钠溶液反应的是
在有________存在并________条件下,乙酸能跟________发生反应生成乙酸乙酯。操作时,应先在试管中加入3mL________,然后一边________,一边慢慢加入2mL________和2mL________。加热后,将产生的蒸气经导管通到________溶液的液面________,该溶液的作用是:(1)________;(2)________;(3)________。在液面上方可看到有________的________状的________生成,并闻到一种________味。在反应中,酸脱去________,醇脱去________。请用示踪原子18O表明该反应的化学方程式:________。该反应是________反应,浓H2SO4的作用是(1)________,(2)________。