氯碱工业是高耗能产业,为了提高原料的利用率,将电解的Y气体作为燃料电池燃料,为电解池供电;X气体作为钛的冶炼原料,在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中氯碱工业装置中的电极未标出,所用的离子交换膜只允许阳离于通过。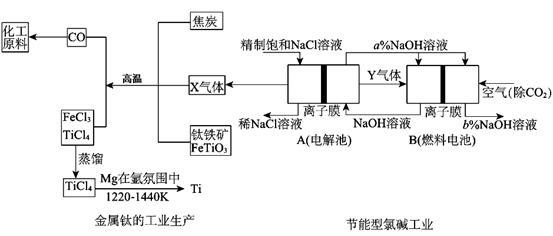
(1)①上图中的节能型氯碱工业部分,X、Y分别是 、 (填化学式),分析比较图示中NaOH质量分数a%与b%的大小 ;
②写出燃料电池B中正极上发生的电极反应: ;
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式 ;
(3) TiCl4暴露在潮湿空气中冒白烟,白烟主要为白色的二氧化钛的水合物H2TiO3,写出该反应的化学方程式 ;
(4)已知:①Mg(s)+Cl2(g)=MgCl2(s) △H=-641kJ·mol-1。
②1/2Ti(s)+ Cl2(g) =1/2TiCl4(1) △H=-385 kJ·mol-1。
则2Mg(s)+TiCl4(1)=2MgCl2(s)+Ti(s)的反应热为
某学生为了测定由两种元素形成的气态化合物X的组成,进行了如图所示的实验,将装置内空气排尽后,把气体X由注射器A缓慢送入装有CuO的B装置,使之完全反应(气态化合物X与CuO均无剩余),得到如下结果: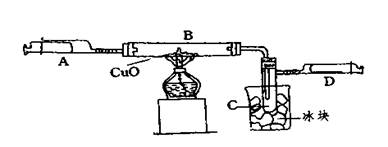
①实验前B管及药品的质量为21.32克,实验后为21.16克
②C管中收集到的物质电解后可得到H2和O2,在D中收集到的是N2。
③X中两元素的质量比是14:3。问:
(1)C中收集到的液体,物质的量是mol;
(2)在实验中看到的现象是。
(3)B中反应的化学方程式是。
实验室用固体NaOH配制240 mL2 mol/L的 NaOH溶液,试回答:
(1)用不到的仪器是.
A.烧杯
B.250 mL容量瓶
C.量筒
D.胶头滴管
E.玻璃棒
F.100 mL容量瓶
G.托盘天平
(2)配制时应称取NaOH ________g .
(3)该实验操作的顺序是(用字母表示).
A.冷却
B.称量
C.计算
D.定容
E.溶解
F.倒转摇匀
G.移液
H.再将洗涤液转移到容量瓶
(4)不当操作可能会引起误差,分析以下操作的影响:(填“偏大”、“偏小”或“无影响”)
①若用2 mol/L 的NaOH溶液先润洗容量瓶,再转移溶液,则实验结果将_______;
②若定容时俯视刻度线,则实验结果将________;
③若溶液未冷却就转移到容量瓶并立即加水至刻度线,则实验结果将。
过量铁粉与稀硝酸反应方程式为:3Fe + 8HNO3 (稀)="=" 3Fe(NO3)2 + 2NO↑ + 4H2O,
(1)该反应的氧化剂是,氧化产物是;
(2)标准状况下,当生成2.24L NO气体时,有g Fe参加反应。
氯气在科技、生产中应用广泛。
(1)工业上常用熟石灰和氯气反应制取漂白粉,化学方程式是___。
(2)实验室用MnO2与浓盐酸反应制取氯气的过程中,可用NaOH溶液吸收尾气,下列试剂也可用于吸收氯气的是____(填字母)。
a.KI溶液 b.FeCl2溶液 c.KCl溶液
写出你选择的一种吸收试剂与Cl2反应的离子方程式:____。
也可用浓氨水吸收氯气,同时生成一种无污染的气体,反应的化学方程式是____。
(3)以粗盐为原料制备亚氯酸钠(NaClO2)的工艺流程如下
写出二氧化氯发生器中生成二氧化氯的离子方程式。
(4)FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
a.检验装置的气密性;
b.通入干燥的Cl2,赶尽装置中的空气;
c.用酒精灯在铁屑下方加热至反应完成;
d.在沉积的FeCl3固体下方加热
e.体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
①装置D中FeCl2的作用是,写出检验FeCl3的离子方程式。
②画出尾气吸收装置E并注明试剂。
③该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,FeCl3与H2S反应的离子方程式为________________。
太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层。
(1)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示。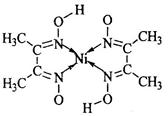
该结构中,
①氮镍之间形成的化学键是________;从原子轨道重叠的方式看,碳碳之间的共价键类型是σ键,则碳氮之间的共价键类型是。
②碳原子的杂化轨道类型有。
③氧氢两元素之间除共价键外还可能存在_______________;
(2)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=;CO与N2互为等电子体.CO的总键能大于N2的总键能,但CO比N2容易参加化学反应.根据下表数据,说明CO比N2活泼的原因是 。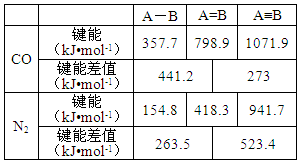
(3)甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醇分子内的O—C—H键角(填“大于”“等于”或“小于”)甲醛分子内的O—C—H键角。