下述实验能达到预期目的的是
| 编号 |
实验内容 |
实验目的 |
| A |
分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 |
研究催化剂对H2O2分解速率的影响 |
| B |
将溴水加入KIO3溶液中 |
比较碘与溴单质氧化性的强弱 |
| C |
将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 |
研究温度对化学平衡的影响 |
| D |
将SO2通入酸性KMnO4溶液中 |
证明SO2具有氧化性 |
某密闭容器中发生如下反应:X(g) + 3Y(g) 2Z(g) ΔH < 0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是:()
2Z(g) ΔH < 0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是:()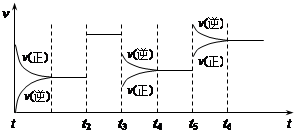
| A.t2时加入了催化剂 |
| B.t3时降低了温度 |
| C.t5时增大了压强 |
| D.该反应最初是从逆反应开始的 |
已知反应FeO(s)+C(s)= CO(g)+ Fe(s)的△H>0,(假设△H,△S不随温度变化而变化),下列叙述中正确的是:()
| A.低温下为自发过程,高温下为非自发过程 |
| B.高温下为自发过程,低温下为非自发过程 |
| C.任何温度下为非自发过程 |
| D.任何温度下为自发过程 |
对于某温度下平衡体系mA(g) + nB(g) pC(g) + qD(g)△H<0,下列说法不正确的是:
pC(g) + qD(g)△H<0,下列说法不正确的是:
A.若温度不变将容器容积扩大到原来的2倍,此时A的浓度变为原来的0.52倍,则m + n > p + q
B.向平衡体系中加入C、D,该反应的△H减小
C.若温度和容器体积不变,充入一定量的惰性气体,B的浓度不变
D.若平衡时,增加A的量,A的转化率下降,B的转化率增加
下列各装置中都盛有0.1 mol·L—1 的NaCl溶液,放置一定时间后,锌片的腐蚀速率由快到慢的顺序是:()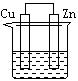
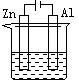
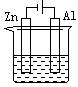
①②③④
| A.③①④② | B.①②④③ | C.①②③④ | D.②①④③ |
在一定体积的密闭容器中放入3升气体R和5升气体Q,在一定条件下发生反应:2R(g)+5Q(g) 4X(g)+nY(g)。反应完全后,容器温度不变,混和气体的压强是原来的87.5%,则化学方程式中的n值是:()
4X(g)+nY(g)。反应完全后,容器温度不变,混和气体的压强是原来的87.5%,则化学方程式中的n值是:()
| A. 2 | B.3 | C.4 | D.5 |