下列事实与氢键有关的是
| A.水加热到很高的温度都难以分解 |
| B.水结成冰体积膨胀,密度变小 |
| C.CH4、SiH4、GeH4、SnH4熔点逐渐升高 |
| D.HF、HCl、HBr、HI的热稳定性依次减弱 |
下列试剂能贮存在磨口玻璃塞的试剂瓶里的是
| A.HF溶液 | B.KOH溶液 | C.盐酸 | D.水玻璃 |
CO2中含有少量HCl,最好用下列哪一种溶液处理:
| A.氨水 | B.饱和石灰水 | C.NaHCO3饱和溶液 | D.Na2CO3饱和溶液 |
下列离子方程式正确的是:
| A.过氧化钠加入水中:2O22-+2H2O="=" 4OH-+O2↑ |
B.碳酸氢钠溶液加入盐酸:CO +2H+==CO2↑+H2O +2H+==CO2↑+H2O |
| C.氢氧化铜中加入盐酸:OH-+H+==H2O |
| D.四氧化三铁跟稀硫酸反应:Fe3O4+8H+==Fe2+ +2Fe3+ + 4H2O |
下列各组离子中,能在碱性溶液中大量共存的是:
A.H+、Na+、Cl-、SO |
B.K+、Na+、SO 、CO 、CO |
| C.Cu2+、K+、Cl-、S2- | D.Ba2+、K+、CO 、HCO 、HCO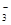 |
下列灭火剂能用于扑灭金属钠着火的是
| A.干冰灭火剂 | B.黄沙 | C.干粉(含NaHCO3)灭火剂 | D.泡沫灭火剂 |