工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用。
(1)某制革厂含硫废水中主要含有物是Na2S。
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因 。
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为 。已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)  Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
①中和含酸废水工业常用的试剂x是 。
②写出H2S气体与足量NaOH溶液反应的化学方程式 。
③铁屑与石墨能形成微型原电池,SO32—在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32—在酸性条件下放电生成H2S的电极反应式: 。
④已知:2H2S(g)+O2(g) =" 2" S(s) +2 H2O(l) △H=" —632.8" kJ/mol
SO2 (g) =" S(s)" + O2(g) △H= +269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为 。
某溶液A中可能含有NH4+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、SO42-中的几种离子,且溶液中各离子的物质的量浓度均为0.1mol.L-1。现取该溶液进行如下实验: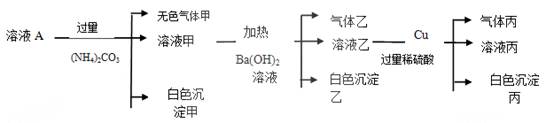
(1)溶液A中一定不存在的离子为____________________________(填离子符号)。
(2)溶液A中加入(NH4)2CO3,生成白色沉淀甲和气体甲的原因是 。
(3)白色沉淀乙的成分为____________________________(填化学式)。
(4)为了进一步确定溶液A中是否含有NH4+,另取10ml该溶液,向其中滴加NaOH溶液,沉淀的物质的量随NaOH溶液体积(mL)的变化如右图所示。据图回答:
①溶液A中______________(填“含有”或“不含有”)NH4+。
②所加NaOH溶液的物质的量浓度为______________mol.L-1 。
③若在A溶液中改加10ml0.2mol.L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为______________mol。
运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01mol.L-1)溶液的PH和原子序数的关系如下图所示。
元素R在周期表中的位置是________________________。
元素Y和W形成的Y2W2型化合物中含有化学键的类型为_____________。
测定Z元素最高价氧化物对应水化物溶液物质的量浓度的方法为______________。
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等。
下列能说明碳、硫两种元素非金属性相对强弱的是____________(填序号)
A.相同条件下水溶液的PH:Na2CO3>Na2SO4
B.酸性:H2SO3 >H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫的危害,其分子结构和CO2相似。
①羰基硫(COS)的电子式为:______________。
②羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下:
已知A是一种正盐,则A的化学式为______________;若气体a为单质,反应II的离子方程式为________________________________________________。
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下:
已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8, Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的PH值分别为3.2、7.04
(1)步骤Ⅰ中生成PbCl2和S的离子方程式 ,加入盐酸的另一个目的是为了控制PH值在0.5~1.0,原因是 。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因 。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式 。
(4)请用离子方程式解释加入H2O2后滤液2可循环利用的原因 ,滤液3是 。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为 。
根据可逆反应: AsO43-+2I-+2H+ AsO33-+I2+H2O,设计如下图所示实验装置。
AsO33-+I2+H2O,设计如下图所示实验装置。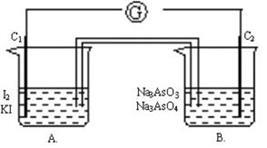
(1)若C1、C2两电极均为碳棒,A烧杯中装有I2 - KI混合溶液,B烧杯中装有Na3AsO4 - Na3AsO3混合溶液,两烧杯中用一装有饱和KI溶液的盐桥相连。开始时电流计指针有偏转,一段时间后指针无偏转,此时反应
(2) (填“停止”或“没有停止”)。向B溶液中加入浓盐酸时发现电流计指针发生偏转,此时原电池的正极反应为:
(3)向B溶液中滴加40%的 NaOH溶液,发现电流计指针向相反方向偏转,此时原电池的负极反应为:
(4)
已知25℃时,CH3COONH4溶液呈中性。
Ⅰ.将0.1 mol·L-1的CH3COOH溶液与0.1 mol·L-1的NaOH溶液等体积混合(混合溶液的体积变化忽略不计),测得混合溶液的pH=9。回答下列问题:
(1)用离子方程式表示混合溶液的pH=9的原因________________________。
(2)混合后溶液中c(CH3COOH)=_________________mol·L-1 (填写精确值)。
(3)相同温度相同浓度的下列四种溶液:①(NH4)2CO3②CH3COONH4③(NH4)2SO4④NH4Cl,pH由大到小的排列顺序为____________________(填序号)。
Ⅱ. Mg(OH)2沉淀可溶解于NH4Cl溶液。同学对有关该反应的原理的解释如下:甲同学认为是NH4Cl水解,溶液呈酸性,H+中和了Mg(OH)2电离出的OH-导致沉淀溶解;乙同学认为是NH与Mg(OH)2电离出的OH-反应生成弱电解质NH3·H2O,导致沉淀溶解。
(4)丙同学不能肯定哪位同学的解释合理,于是选用下列一种试剂来验证甲、乙两同学的观点,他选用的试剂是( )
| A.NH4NO3 | B.CH3COONH4 | C.Na2CO3 | D.NH3·H2O |
(5)丙同学选择该试剂的理由是:_____________________。
(6)丙同学将所选试剂滴加到Mg(OH)2悬浊液中,Mg(OH)2溶解,由此可知:________(填“甲”或“乙”)的解释更合理。Mg(OH)2沉淀与NH4Cl溶液反应的离子方程式为:____________________。
(7)现有Mg(OH)2和Al(OH)3沉淀的混合物,若除去Mg(OH)2得到纯净的Al(OH)3,可用______________(填写所用试剂的化学式,试剂从本题涉及的试剂中选取,下同);若除去Al(OH)3得到纯净的Mg(OH)2,可用_________________。