短周期主族元素A、B、C、D、E,原子序数依次增大,A元素的单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。
(1)已知相关物质之间存在如下变化: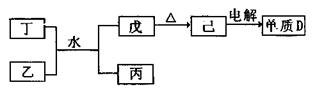
①丁与乙和水反应生成戊和丙的离子方程式为 ,由物质己电解得到单质D的化学方程式为 ;
②0.1mol/L的丙溶液中所含离子浓度由大到小排列顺序为 ;常温下,为使丙溶液中由丙电离的阴、阳离子浓度相等,应向溶液中加入一定量的乙的水溶液至 。
(2)已知E及其化合物有以下变化:
写出单质E与化合物Z在一定条件下反应生成X和水的化学方程式___ _,由A、B、C、D、E5种元素中的两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为 (任写一个即可)。
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的C的含氧酸盐的化学式是 。
①常温下,0.05mol/L硫酸溶液中,C(H+)=mol/L,
水电离的C(H+)=mol/L
②某温度,纯水中C(H+)==3×10-7mol/L,则:
纯水中C(OH-)="=" mol/L,此时温度(填“高于”“低于”或“等于”)25℃。若温度不变,滴入盐酸后C(H+)=5×10-4mol/L,
则溶液中C(OH-)= mol/L,由水电离的C(H+)="=" mol/L。
反应m A+n B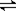 p C在某温度下达到平衡。
p C在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是______ _________;
②若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向______方向移动;
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为______态。
、已知:2H2(g)+O2(g)=2 H2O(l) △H=" -571.6" kJ·mol-1
H2(g)+1/2O2(g)=H2O(g)ΔH=" -241.8" kJ/mol
C3H4(g)+4O2(g) =3CO2(g) +2H2O(g)△H=" -2100.0" kJ·mol-1
根据上面两个热化学方程式回答下列问题:
(1)的燃烧热为;
(2)1mol和2molC3H4组成的混合气体完全燃烧生成液态水时释放的热量为
;
(3)现有和C3H4的混合气体 共5mol,完全燃烧生成CO2和气态水时,则放出热量(
共5mol,完全燃烧生成CO2和气态水时,则放出热量( Q)的取值范围是;若生成CO2和H2O的物质的量相等,则放出的热量是。
Q)的取值范围是;若生成CO2和H2O的物质的量相等,则放出的热量是。
、现有下列物质:①H2S、②NH3、③H2SO4、④NaHCO3、
⑤CH3COOH、⑥KNO3溶液、⑦盐酸、⑧酒精、⑨二元酸H2A等。请回答下列问题(请填入序号)。
(1)其中一定属于弱电解质的是。不能确定的是,请设计一个实验以证明它是强电解质还是弱电解质。你的实验和结论是
;
(2)H2S在水中的电离方程式为__________;
NaHCO3在水中的电离方程式为; 已知H2A的电离方程式为:H2A ="=" H++HA-; HA-H++A2-。试判断H2A是电解质(填“强”或“弱”)。
已知H2A的电离方程式为:H2A ="=" H++HA-; HA-H++A2-。试判断H2A是电解质(填“强”或“弱”)。
(3)2mol/L的盐酸和2mol/L的醋酸各100ml,分别与过量的Zn反应,生成H2的体积,V(盐酸)V(醋酸)(填>、=或<);氢离子浓度相等的盐酸和醋酸各100ml,分别与过量的Zn反应,生成H2的体积V(盐酸)V(醋酸) (填>、=或<);理由是
; (4)已知CH3COO-+H+ CH3COOH;现要使平衡向右移动且氢离子浓度增大,应采取的措施是()
(4)已知CH3COO-+H+ CH3COOH;现要使平衡向右移动且氢离子浓度增大,应采取的措施是()
| A.加NaOH | B.加盐酸 | C.加水 | D.升高温度 |
已知CH3COOH在溶剂A中可以全部电离,盐不溶解于A溶剂。则CH3COOH在溶剂A中的电离方程式为;CH3COOH和Na2CO3在溶剂A中生成CO2反应的离子方程式是。
完成下列化学方程式或离子反应方程式:
(1)葡萄糖与银氨溶液水浴加热反应的化学方程式:
_______________________________________________________________;
(2)氢氧化铝和氢氧化钠溶液反应的离子方程式:
________________________________________________________________。