烯烃中碳碳双键是重要的官能团,在不同条件下能发生多种变化。
已知①烯烃在催化剂作用下的复分解反应就是两种烯烃交换双键两端的基团,生成两种新烯烃的反应。
②烯烃与酸性高锰酸钾溶液反应的氧化产物有如下的对应关系:
上述转化关系图中的物质:A和B都属于烃类,F是安息香酸,其蒸气密度是同温同压下H2密度的61倍,将0.61g F完全燃烧,产物通入足量的澄清石灰水中,产生3.5g沉淀。
根据以上信息回答下列问题:
(1)B的产量可以用来衡量一个国家石油化工发展的水平,B的名称是 。
(2)E的同体可用于人工降雨,E的电子式是 。
(3)H→I的反应类型是 。
(4)L在一定条件下也可以生成一种高分子化合物W0 W可以作为手术的缝合线,其优点之一就是免拆线可被人体吸收。用W制成的塑料饭盒可降解,是环境友好材料。写出由L制W的化学方程式: 。
(5)A的结构简式为: (任写一个)。
(6)K物质的核磁共振氢谱图上有____个吸收峰。
(7)若将NaOH溶于I后再与H混合加热,反应生成的有机产物最多有 种,写出住意两种物质的结构简式(同一个碳原子上连有两个碳碳双键的结构不稳定,可不考虑)
、 。
(12分)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
请回答下列问题:
⑴流程甲中,固体A的主要成分是______(填化学式,下同),沉淀B的主要成分是_______,生成沉淀C的离子方程式为__________________。
⑵流程乙中,加过量烧碱时发生反应的离子方程式为________________,沉淀E的主要成分是_________。
⑶生成沉淀F的离子方程式为____________________________________。
(12)氨是重要的无机化工原料,也是合成氮肥的主要原料,因此合成氨在国民经济中占有重要地位。
⑴工业合成氨反应的化学方程式为。
⑵恒温下,向一个2L的密闭容器中充入1mol N2和2.6mol H2,20min时,反应达到平衡,容器内c(NH3)为0.08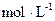 ,则c(H2)=,20min内,用N2浓度的变化表示的反应速率为。
,则c(H2)=,20min内,用N2浓度的变化表示的反应速率为。
⑶某温度下,向一个2L的密闭容器中充入1mol N2和3mol H2,在恒温下反应,以下能说明反应达到平衡状态的是
①单位时间内消耗0.1molN2的同时生成0.2molNH3
②单位时间内生成0.3molH2的同时生成0.2molNH3
③n(N2)∶n(H2 )∶n(NH3)=1∶3∶2
)∶n(NH3)=1∶3∶2
④c(NH3)=0.08mol/L
⑤容器内压强不变
⑷工业上约有80%的氨用于制造化肥。某化肥厂生产铵态氮肥(NH4)2SO4的反应可表示为:Ca SO4+2NH3+CO2+H2O= CaCO3+(NH4)2SO4
SO4+2NH3+CO2+H2O= CaCO3+(NH4)2SO4
①反应前先将CaSO4磨成粉末,加入水中制成悬浊液,则所得分散系中分散质粒子直径10-7m(填“>”或“<”)。
②向CaSO4悬浊液中通入气体时,需先通入足量NH3再通入CO2,原因是。
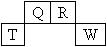
(12分)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中Q所处的周期序数是其主族序数的一半,请回答下列问题:
 ⑴T的原子结构示意图为_____________。
⑴T的原子结构示意图为_____________。 ⑵原子的得电子能力:Q______W(填“强于”或“弱于”)。
⑵原子的得电子能力:Q______W(填“强于”或“弱于”)。 ⑶原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是________________________________。
⑶原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是________________________________。 ⑷W的单质与其最高价氧化物对应的水化物的浓溶液共热能发生反应,生成
⑷W的单质与其最高价氧化物对应的水化物的浓溶液共热能发生反应,生成 两种物质,其中一种是气体,
两种物质,其中一种是气体, 反应的化学方程式为_______________。
反应的化学方程式为_______________。 ⑸R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是___________。
⑸R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是___________。
2010年美、日三位科学家因钯(Pd)催化的交叉偶联反应获诺贝尔化学奖。一种钯催化的交叉偶联反应如下:
( 、
、 为烃基或其他基团)
为烃基或其他基团)
应用上述反应原理合成防晒霜主要成分K的路线如下图所示(部分反应试剂和条件未注明):
已知:①B能发生银镜反应,1 mol B最多与2 mol H2反应。
②C8H17OH分子中只有一个支链,且为乙基,其连续氧化的产物能与NaHCO3反应生成CO2,其消去产物的分子中只有一个碳原子上没有氢。
③G不能与NaOH溶液反应。
④核磁共振图谱显示J分子有3种不同的氢原子。
请回答:
(1)B中含有的官能团的名称____________。
(2)B→D的反应类型___________。
(3)D→E的化学方程式___________。
(4)有机物的结构简式:G___________;K___________。
(5)符合下列条件的同分异构体有(包括顺反异构)__________种:其中一种的结构简式是___________。
a. 与D互为同系物 b. 相对分子质量是86
(6)分离提纯中间产物E的操作:先用碱除去D和H2SO4,再用水洗涤,弃去水层,最终通过___________操作除去C8H17OH,精制得E。
迷迭香酸是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,其结构如下图所示。
某同学设计了迷迭香酸的合成线路:
已知:①
 、
、 表示烃基或氢原子;
表示烃基或氢原子;
②苯环上的羟基很难直接与羧酸发生酯化反应。
(1)迷迭香酸分子中所含官能团的名称是羟基、碳碳双键、___________和___________。
(2)A的结构简式为___________。
(3)C的结构简式为___________。
(4)D、E反应的化学方程式为______________________。
(5)与E互为同分异构体且同时满足下列条件的有机物有____种,写出其中任意两种同分异构体的结构简式:___________、__________。
①苯环上共有四个取代基,且苯环上只有一种化学环境的氢原子;
②1mol该同分异构体分别与NaHCO3、NaOH反应时,最多消耗NaHCO3、NaOH的物质的量分别是1mol、4mol。