家用液化气中的主要成分之一是丁烷,当10 kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105 kJ,试写出丁烷燃烧反应的热化学方程式__________________________。
已知1 mol液态水汽化时需要吸收44 kJ的热量,则1 mol丁烷完全燃烧并生成气态水时放出的热量为_______________kJ。
25时,如果取0. 1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);(填>、<、=)
(3)求出混合液中下列算式的计算结果(填具体数字):
c (HA)+c (A-)=mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH7 (填>、<、=);
(5)将相同温度下相同浓度的四种盐溶 液:
液:
A.NH4HCO3 B.NH4AC.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列(填序号)
依据氧化还原反应: 2Ag+(aq) + Cu(s) ="==" Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题:
2Ag+(aq) + Cu(s) ="==" Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题: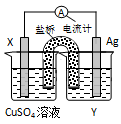
(1)电极X的材料是;电解质溶液Y是。
(2)外电路中的电子是从电极流向电极。
(3)银电极上发生的电极反应式为
25℃时,50mL 0.10mol/L的醋酸中存在着如下平衡:
CH3COOH  CH3COO―+H+
CH3COO―+H+
加入少量冰醋酸,平衡将______(填“向右移动”、“向左移动”或“不移动”),溶液中C(H+)将_______(填“增大”、“减小”或“不变”),醋酸的电离程度将__________(填“增大”、“减小”或“不变”)。
(9分)已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z ,且存在如下转化关系,试推断回答下列问题。
,且存在如下转化关系,试推断回答下列问题。
(1)D元素原子的结构示意图为 ;
(2)A、B、C三种元素的原子半径由小到大的顺序为(用元素符号表示);
(3)Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式为
;
(4)A与D两元素的气态氢化物之间可以反应生成一种盐,该盐的水溶液呈_________(填“酸”、“碱”或“中”)性;
(5)实验室中,应将X的浓溶液保存在棕色试剂瓶中,其原因是
(用化学方程式表示)。
(10分)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是 ,向其中加入少量KOH溶液时,发 生反应的离子方程式是 ;
生反应的离子方程式是 ;
(2)现将0.04 mol·L-1HA溶液和0.02 mol·L-1NaOH溶液等体积混合,得到缓冲溶液。
①若HA为HCN ,该溶液显碱性,则溶液中c(Na+) c(CN-)(填“<”、“=”或“>”),你得出该结论的依据是
,该溶液显碱性,则溶液中c(Na+) c(CN-)(填“<”、“=”或“>”),你得出该结论的依据是
②若HA为CH3COOH,该溶液显酸性。溶液中所有的离子按浓度由大到小排列的顺序是 。