金属氢氧化物在酸中溶解度不同,因此可以利用这一性质, 控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(s,mol·L-1)见图。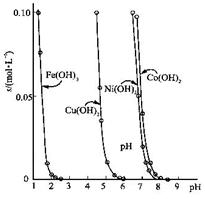
(1)pH=3时溶液中铜元素的主要存在形式是: (写化学式)
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为 (填字母)
A、<1 B、4左右 C、>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质, (能、不能)通过调节溶液pH的方法来除去,理由是
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以 加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式。
加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式。
(5)已知一些难溶物的溶度积常数如下表。
| 物质 |
FeS |
MnS |
CuS |
PbS |
HgS |
ZnS |
| Ksp |
6.3×10-18 |
2.5×10-13 |
1.3×10-36 |
3.4×10-28 |
6.4×10-53 |
1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的 除去它们的是 。(选填序号)
A、NaOH B、FeS C、Na2S
Ⅰ(4分)(1)写出表示含有8个质子、10个中子的原子的化学符号。
(2)元素周期表中,所含元素超过18种的周期是。
Ⅱ有:① 168O、178O、188O ②H2O、D2O ③石墨、金刚石④H、D、T 四组微粒或物质,回答下列问题:
(1)互为同位素的是___________;(2)互为同素异形体的是_______________;
(3)由①和④中微粒能结合成含三个原子的化合物,这些化合物中分子量最大的是_____________(填化学式)。
已知:2SO2(g)+O2(g) 2SO3(g)ΔH=-196.0kJ·mol-1
2SO3(g)ΔH=-196.0kJ·mol-1
2NO(g)+O2(g) 2NO2(g)ΔH="-113.0" kJ·mol-1
2NO2(g)ΔH="-113.0" kJ·mol-1
2SO3(l) 2SO3(g)ΔH=" 20.0" kJ·mol-1
2SO3(g)ΔH=" 20.0" kJ·mol-1
则NO2与SO2反应生成SO3(l)和一种无色气体的热化学方程式;
若在一定条件下,将NO2与SO2以体积比1:2置于恒容密闭容器中发生上述反应,
①下列能说明反应达到平衡状态的是。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
②该反应达平衡时,测得NO2的转化率为50%,则反应前后容器内压强比为。
③恒压密闭容器中发生上述反应时,若加入Ar气,使得反应速率(变大、变小或不变)。
氮化碳是化工行业新合成的一种硬度比金刚石还大的晶体材料,已知在此化合物中各元素均处于其最高或最低价态,据此推断:
(1)氮化碳的化学式可能是___________。
(2)氮化碳的晶体类型为________,该晶体中微粒间的作用力是________。
(3)氮化碳晶体可能还具有的性质或特点有________。
①熔点很高 ②可以导电 ③不存在单个分子 ④具有空间网状结构
(1)在下列变化中①I2升华,②烧碱熔化,③二氧化硅熔化,④NaCl溶于水,⑤H3PO4熔融,⑥O2溶于水,⑦Na2O2溶于水,⑧NaHSO4溶于水。未破坏化学键的是;仅离子键被破坏的是;仅共价键被破坏的是;离子键和共价键都被破坏的是。
(2)判断:①SiC,②CO2,③Br2,④KCl晶体的熔点由高到低排列的顺序:(序号)
已知
分别代表一种物质,它们之间的转化关系如下图所示(反应条件略)。
分别是由短周期元素组成的单质。
与冷水缓慢反应,与沸水迅速反应,放出氢气。
是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。
为淡黄色固体化合物,
能与
的水溶液反应生成蓝色沉淀。请回答下列问题:
⑴组成
单质的元素位于周期表位置。化合物
电子式为。
⑵
的沸点比硒化氢(
)的熔沸点高,其原因是。
⑶
与在一定条件下也可直接反应生成
和
, 写出化学方程式:。
⑷写出
与水反应的化学方程式:。
⑸红棕色污染气体
的处理具有实际意义。现在常利用反应
 (方程没配平)来处理
。当转移0.4
电子时,消耗的M在标准状况下是
。
(方程没配平)来处理
。当转移0.4
电子时,消耗的M在标准状况下是
。