(13分)摩尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂。某研究性学习小组用下图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1) 用30%的NaOH溶液和废铁屑(含少量油污、铁锈等)混合、煮沸,以除去铁屑表面油污,然后冷却、洗涤、分离,将分离出的NaOH溶液装入③中,废铁屑放入②中。
(2) 利用容器②的反应,向容器①中通入氢气,应关闭活塞 ,打开活塞 (填字母)。向容器①中通人氢气的目的是 。
待锥形瓶中的铁屑快反应完时,关闭活塞 ,打开活塞 ②中继续产生的氢气会将 (填①、②或③,后同)容器中的溶液压入① 容器,在常温下放置一段时间,混合溶液底部将结晶析出硫酸亚铁铵。
(3) 为了确定产品中亚铁离子的含量,研究小组用滴定法来测定。
①试配平反应的离子方程式:
②滴定时,将KMnO4溶液装在 (酸式或碱式)滴定管中,判断反应到达滴定终点的现象为 。
(4)装KMnO4滴定管用蒸馏水润洗后,未用KMnO4液润洗导致滴定结果(填“偏小”、“偏大”或“无影响”) 。
(5)观察装KMnO4滴定管读数时,若滴定前仰视,滴定后俯视则结果会导致测得的Fe2+溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)
锗及其化合物被广泛应用于半导体、催化剂等领域。以铅锌矿含锗烟尘为原料可制备GeO2,其工艺流程图如下。
已知:GeO2是两性氧化物;GeCl4易水解,沸点86.6℃;PbO不溶于稀硫酸
(1)第①步滤渣主要成分有 (填化学式),实验室萃取操作用到的玻璃仪器有 。
(2)第③步萃取时,锗的萃取率与V水相/V有机相(水相和有机相的体积比)的关系如图所示,从生产成本角度考虑,较适宜的V水相/V有机相的值为 。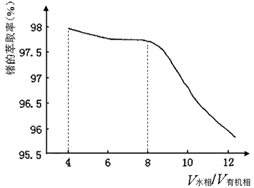
(3)第④步加入盐酸作用 (答两点即可)。
(4)第⑤步反应的化学方程式 。
(5)检验GeO2·nH2O是否洗涤干净的操作是 。
(6)GeO2产品中通常混有少量SiO2。取样品5.4g,测得其中氧原子的物质的量为 0.105mol,则该样品中GeO2的物质的量为___________mol
Ⅰ.乙组同学用下列装置来证明铜与稀硝酸反应产生一氧化氮,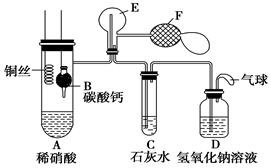
B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为________________________。
(3)装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是 。
(4)一段时间后,C中白色沉淀溶解,其原因是____________________。
(5)装置D的作用是________________________。
Ⅱ.已知向含有淀粉的10mL0.2mol/LKIO3酸性溶液滴滴加0.3mol•L-1NaHSO3溶液的过程中,溶液的颜色先变蓝然后褪色,发生的离子反应如下:
①______IO3-+______HSO3-=_______I2+_______SO42-+_______H2O+ ________
②I2+HSO3-+H2O═2I-+SO42-+3H+
回答下列问题
(1)配平离子反应方程式①
______IO3-+______HSO3-=_______I2+_______SO42-+_______H2O+ ________
(2)根据①②反应写出还原性粒子HSO3-、I2、I-由强到弱的顺序_________________;
(3)当溶液刚好褪色时,则消耗的NaHSO3溶液的体积为___________________;
(4)预测已知向含有淀粉的NaHSO3溶液滴加KIO3溶液的现象____________________
氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁,实验室制备装置和工业制备流程图如下: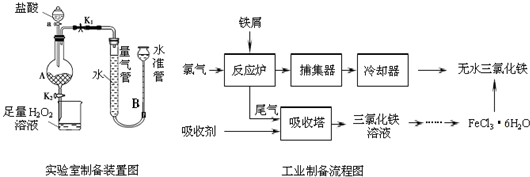
已知:(1)无水FeCl3的熔点为555K、沸点为588K.
(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
20 |
80 |
100 |
| 溶解度(g/100g H2O) |
74.4 |
91.8 |
525.8 |
535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3•6H2O晶体.
请回答:
(1)烧杯中足量的H2O2溶液的作用是______________________。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是______________________。
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入______________后、_________________、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(4)试写出吸收塔中反应的离子方程式:_____________________。
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为____________。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-═2I-+S4O62-).
①滴定终点的现象是:_____________________。
②样品中氯化铁的质量分数________________。
(a)铁元素在人类生活中扮演着非常重要的角色,不仅仅是重要的建筑材料,也是人体必须的微量元素。每年钢铁的腐蚀带来巨大的经济损失。某校研究小组在实验室中模拟钢铁在自然环境下的腐蚀,设置如下装置,几天后观察结果:
请回答下列问题:
(1)请比较以上三个装置中右侧导管中红墨水的高度: > > 。请写出A装置中,钢铁锈蚀时正极反应的电极反应式 。
(2)钢铁的防腐有重大的意义,生活中常将金属制品放在干燥处或者涂上矿物油予以保护,现请你从电化学角度设计一种方法保护下图中钢铁以免被腐蚀,请将下图完成:
(b)下面是一种常见补铁药品说明书中的部分内容:该药品含Fe2+:33%~36%,不溶于水但能溶于人体中的胃酸,与Vc(维生素C)同服可增加本品吸收。某乙同学采用在酸性条件下用高锰酸钾标准溶液滴定的方法测定该药品是否合格,反应原理为:
5 Fe2++8H++MnO4-="5" Fe3++Mn2++4H2O
准确称量上述药品10.00g,将其全部溶于试剂1中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
(3)该实验中的试剂1是 (填序号)。
A.蒸馏水B.稀盐酸C.稀硫酸D.稀硝酸
(4)请简述判断滴定终点的现象: 。
(5)请通过计算,说明该药品含铁量是否合格 (填“合格”或“不合格”)(Fe的摩尔质量为56g/mol)
聚合硫酸铁铝(PFAS)是一种新型高效水处理剂。利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源,粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如下: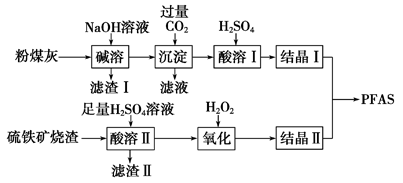
(1)“碱溶”时,Al2O3发生反应的化学方程式为______________________________。
(2)“酸溶Ⅱ”时,Fe3O4发生反应的离子方程式为____________________________。
(3)“滤渣Ⅰ”、“滤渣Ⅱ”在本流程中能加以利用的是_______________________。
(4)“氧化”时应控制温度不超过57 ℃,其原因是____________________________。
(5)“氧化”时若用MnO2代替H2O2,发生反应的离子方程式是____________________。
(6)酸度对絮凝效果和水质有显著影响。若产品PFAS中残留硫酸过多,使用时产生的不良后果是________________________。