氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁,实验室制备装置和工业制备流程图如下: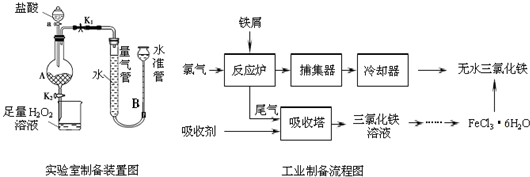
已知:(1)无水FeCl3的熔点为555K、沸点为588K.
(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
20 |
80 |
100 |
| 溶解度(g/100g H2O) |
74.4 |
91.8 |
525.8 |
535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3•6H2O晶体.
请回答:
(1)烧杯中足量的H2O2溶液的作用是______________________。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是______________________。
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入______________后、_________________、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(4)试写出吸收塔中反应的离子方程式:_____________________。
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为____________。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-═2I-+S4O62-).
①滴定终点的现象是:_____________________。
②样品中氯化铁的质量分数________________。
(16分)西安北郊古墓中曾出土一青铜锤(一种酒具),表面附着有绿色固体物质,打开盖子酒香扑鼻,内盛有26 kg青绿色液体,专家认定是2000多年前的“西汉美酒”。这是我国考古界、酿酒界的一个重大发现。
(1)上述报道引发了某校化学兴趣小组同学的关注,他们收集家中铜器表面的绿色固体进行探究。
提出问题:铜器表面附着绿色固体物质是由哪些元素组成的?
猜想:查阅相关资料后,猜想绿色固体物质可能是铜绿。
实验步骤: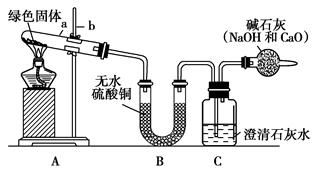
①对试管内的绿色固体进行加热,至完全分解。观察到A装置中绿色固体
逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊。
②取少量加热后生成的黑色固体于试管中,加入稀硫酸。观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝。观察到铁丝表面有红色物质析出。
④实验结论:绿色固体物质中含有________、________、________、________等元素。(提示:装置内的空气因素忽略不计)
(2)表达与交流
①图中标有a、b的仪器名称是:a________;b________。
②上述实验步骤③中发生反应的离子方程式____________________________________。
③干燥管中的碱石灰作用是什么?若反应结束后,如果先移去酒精灯,可能出现的现象是什么?
④如果将B、C两装置对调行吗?________。为什么?
____________________________________。
海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
(1)实验室焙烧海带,需要下列仪器中的________(填序号)。
a.试管 b.烧杯
c.坩埚 d.泥三角
e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①________,③__________。
(3)提取碘的过程中,可选择的有机试剂是 ( )
| A.甲苯、酒精 | B.四氯化碳、苯 |
| C.汽油、乙酸 | D.汽油、甘油 |
(4)③过程需要使用的主要玻璃仪器为______________。
(5)某小组用CCl4萃取碘水中的碘,在如图的分液漏斗中,下层液体呈 ______色;他们打开分液漏斗活塞,却未见液体流下,原因可能是___________。
(6)从含碘的有机溶液中提取碘和回收有机溶剂,所用的分离方法为
某课外活动小组结合以下材料制酚醛树脂。用苯酚和甲醛为原料,在酸或碱的催化作用下缩聚而成。苯酚过量,在酸性催化剂作用下,缩聚成线型结构的热塑性酚醛树脂。甲醛过量,在碱性催化剂作用下,缩聚成体型结构的热固性酚醛树脂。设计实验如下:
Ⅰ.用盐酸作催化剂
在一个大试管里加入苯酚2 g,注入3 mL甲醛溶液和3滴浓盐酸混合后,用带有玻璃管的橡皮塞塞好,放在沸水浴里加热约15 min。待反应物接近沸腾时,液体变成白色浑浊状态。从水浴中取出试管,用玻璃棒搅拌反应物,稍冷。将试管中的混合物倒入蒸发皿中,倾去上层的水,下层就是缩聚成线型结构的热塑性酚醛树脂(米黄色中略带粉色)。它能溶于丙酮、乙醇等溶剂中。
Ⅱ.用浓氨水作催化剂
在另一个试管里加入2.5 g苯酚,注入3 mL~4 mL 40%的甲醛溶液,混匀后再加1 mL浓氨水,振荡混合,也用带有玻璃管的橡皮塞塞好,在水浴中加热(装置如下图)。约15 min后,试管里逐渐出现白色的浑浊物,暂停加热。待发生的气泡稍少时,再继续加热,过一会儿,就变成黏稠的半流动性液体。将所得黏稠物倒入一瓷蒸发皿里,在50 ℃下烘1 h后,再继续在70~80 ℃下烘8 h,即能缩合成体型固体酚醛树脂(淡黄色),它不溶于任何溶剂。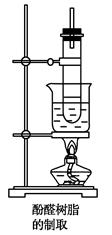
(1)写出酸性条件下生成酚醛树脂的反应方程式。
①________________________________________________________________________;
②________________________________________________________________________。
(2)实验装置采用沸水浴加热的原因
________________________________________________________________________
________________________________________________________________________。
(3)长玻璃导管起的作用为
________________________________________________________________________
________________________________________________________________________。
下图为硬脂酸甘油酯在碱性条件下水解的装置图,进行皂化反应时的步骤如下:
(1)在圆底烧瓶中加入7~8 g硬脂酸甘油酯,然后加入2~3 g的氢氧化钠、5 mL水和10 mL酒精,加入酒精的作用是__________________________________。
(2)隔着石棉网给反应混合物加热约10 min,皂化反应基本完成,所得的混合物为________(选填“悬浊液”、“乳浊液”、“溶液”或“胶体”)。
(3)向所得混合物中加入________,静置一段时间后,溶液分为上下两层,肥皂在________层,这个操作称为____________。
(4)图中长玻璃导管的作用为
________________________________________________________________________。
(5)写出该反应的化学方程式:
________________________________________________________________________
________________________________________________________________________。
氧化镁分轻质氧化镁和重质氧化镁两种。轻质体积疏松,为白色无定形粉末。无臭无味无毒。密度3.58g/cm3。难溶于纯水及有机溶剂,在水中溶解度因二氧化碳的存在而增大。能溶于酸、铵盐溶液。经高温灼烧转化为结晶体。遇空气中的二氧化碳生成碳酸镁复盐。重质体积紧密,为白色或米黄色粉末。与水易化合,露置空气中易吸收水分和二氧化碳。与氯化镁溶液混合易胶凝硬化。在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
(1)MgCO3与稀硫酸反应的离子方程式为_______ _______________。
(2)加入H2O2氧化时,发生反应的化学方程式为______ _______________。
(3)加氨水调节至溶液的ph=4的目的:
滤渣2的成分是______(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C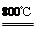 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C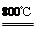 MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C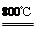 MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。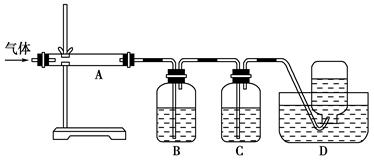
①D中收集的气体是________(填化学式)。
②B中盛放的溶液可以是________(填字母)。
a.NaOH溶液 b.KMnO4溶液 c.稀硝酸 d.Na2CO3溶液
并写出相应的离子反应方程式:
③A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素的最高价态为+4,
写出该反应的离子方程式:_________________________________________。