聚合硫酸铁铝(PFAS)是一种新型高效水处理剂。利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源,粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如下: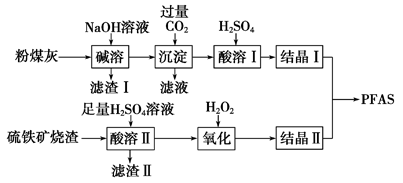
(1)“碱溶”时,Al2O3发生反应的化学方程式为______________________________。
(2)“酸溶Ⅱ”时,Fe3O4发生反应的离子方程式为____________________________。
(3)“滤渣Ⅰ”、“滤渣Ⅱ”在本流程中能加以利用的是_______________________。
(4)“氧化”时应控制温度不超过57 ℃,其原因是____________________________。
(5)“氧化”时若用MnO2代替H2O2,发生反应的离子方程式是____________________。
(6)酸度对絮凝效果和水质有显著影响。若产品PFAS中残留硫酸过多,使用时产生的不良后果是________________________。
(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表(表中不要留空格)。
| 实验编号 |
实验目的 |
T/℃ |
NO初始浓度 mol/L |
CO初始浓度 mol/L |
同种催化剂的比表面积m2/g |
| Ⅰ |
为以下实验作参照 |
280 |
6.50×10-3 |
4.00×10-3 |
80 |
| Ⅱ |
120 |
||||
| Ⅲ |
探究温度对尾气转化速率的影响 |
360 |
6.50×10-3 |
4.00×10-3 |
80 |
【图像分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为__________________;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率_____________(填“增大”、“减小”、“无影响”)。
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥。而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2 2NH3
2NH3
(1)在N2+3H2 2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为;
A.2 sB.3 sC.4 sD.6 s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是 ;
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.1 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min-1 D.v(N2)=0.002mol·L-1·s-1
(3)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是。
2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是。
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂1mol N≡N键的同时,断裂6 mol N—H键
D.反应消耗N2、H2与产生NH3的速率之比1︰3︰2
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 |
室温下,试管中所加试剂及其用量/mL |
溶液褪至无色所需时间/min |
|||
| 0.6mol/L H2C2O4溶液 |
H2O |
3mol/L 稀H2SO4溶液 |
0.05mol/L KMnO4溶液 |
||
| 1 |
3.0 |
2.0 |
2.0 |
3.0 |
1.5 |
| 2 |
2.0 |
3.0 |
2.0 |
3.0 |
2.7 |
| 3 |
1.0 |
4.0 |
2.0 |
3.0 |
3.9 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是__________________________________。
(2)利用实验1中的数据,计算用KMnO4表示的化学反应速率为____________________。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。
该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是____________________。
②请你帮助该小组同学完成实验方案,并填写表中空白
| 实验编号 |
室温下,试管中所加试剂及其用量 |
再向试管中加入某种固体 |
溶液褪至无色所需时间/min |
|||
| 0.6mol/L H2C2O4溶液 |
H2O |
3mol/L 稀H2SO4溶液 |
0.05mol/L KMnO4溶液 |
|||
| 4 |
_________ |
2.0 |
2.0 |
3.0 |
MnSO4 |
t |
③若该小组同学提出的假设成立,应观察到________________现象.
银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
已知:Al(OH)3和Cu(OH)2的分解温度分别为450 oC和80oC。
(1)电解精炼银时,阴极上发生反应的电极反应为:________________;滤渣A与稀硝酸反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为:______________。
(2)最后一步在惰性气氛中煅烧固体B的过程中发生的反应有只有两个:(1)2Al(OH)3=Al2O3+3H2O;(2)____CuO +____Al2O3=____CuAlO2+_____↑(完成并配平该反应方程式)。
(3)固体B的组成为_______________;在生成固体B的过程中应严格控制NaOH的加入量,若NaOH过量,发生反应的离子方程式为:__________________________________。
(4)CuSO4溶液也可用于制备胆矾,其基本操作是__________、冷却结晶、__________、洗涤和低温干燥。
(14分)
Ⅰ:“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
(1)浓硫酸的作用是:①;②;
(2)现拟分离乙酸乙酯、乙酸、乙醇的混合物,下图是分离操作流程图。完成下列空白:
试剂:a______________,b______________。
分离方法:①_____________③_____________
物质名称:A_____________, C_____________
Ⅱ:已知卤代烃(R-X)在碱性条件下可水解得到醇(R-OH),如:CH3CH2-X+H2O  CH3CH2-OH+HR,现有如下转化关系:
CH3CH2-OH+HR,现有如下转化关系:
回答下列问题:
(1)反应1的条件为 __________,X的结构简式为______
(2)写出反应3的方程式______________________。
Ⅲ:写出苹果酸
①和乙醇完全酯化的反应的化学方程式___________________。
②和过量的Na2CO3溶液反应的化学方程式___________________。
下图为实验室制取溴苯的三个装置,根据要求回答下列各题: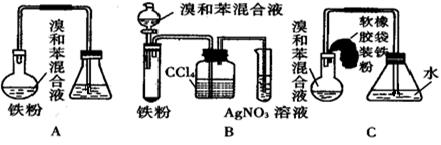
(1)装置A烧瓶中发生反应的化学方程式是;装置A中左侧长导管的作用是;装置A和C中的两处明显错误是、。
(2)在按装置B、C装好仪器及药品后要使反应开始,应对装置B进行的操作是,应对装置C进行的操作是。
(3)装置B、C较好地解决了A中加装药品和使装置及时密封的矛盾,方便了操作。A装置中这一问题在实验中造成的后果是。
(4)B中采用了洗气瓶吸收装置,其作用是。反应后洗气瓶中可能出现的现象是。
(5)B装置也存在两个明显的缺点,其中之一与A、C中的错误相同,而另一个缺点是:。