(14分)
Ⅰ:“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
(1)浓硫酸的作用是:① ;② ;
(2)现拟分离乙酸乙酯、乙酸、乙醇的混合物,下图是分离操作流程图。完成下列空白:
试剂:a______________,b______________。
分离方法:①_____________③_____________
物质名称:A_____________, C_____________
Ⅱ:已知卤代烃(R-X)在碱性条件下可水解得到醇(R-OH),如:CH3CH2-X+H2O  CH3CH2-OH+HR,现有如下转化关系:
CH3CH2-OH+HR,现有如下转化关系:
回答下列问题:
(1)反应1的条件为 __________,X的结构简式为______
(2)写出反应3的方程式______________________。
Ⅲ:写出苹果酸 
①和乙醇完全酯化的反应的化学方程式___________________。
②和过量的Na2CO3溶液反应的化学方程式___________________。
可用于分离或提纯物质的方法有:
| A.分馏 | B.盐析 | C.过滤 | D.重结晶 E.升华 F.渗析 G.电解 H.加热分解 I.蒸馏 J.灼热氧化 |
如欲分离或提纯下列各组混合物,请选择上述方法中最合适者,并将相应字母填入题后空格内:
(1)从石油中分离出汽油和煤油等成分________;
(2)除去淀粉溶液中的少量碘化钠________;
(3) 从油脂皂化反应的混合液中分离出高级脂肪酸钠________;
从油脂皂化反应的混合液中分离出高级脂肪酸钠________;
(4)除去粗铜中锌、银等 金属________;
金属________;
(5)除去水中的Na+、SO、Cl-等杂质________;
(6)除去KNO3晶体中混有的少量N aCl________.
aCl________.
某探究性学习小组拟用小颗粒状铝硅合金与足量稀硫酸的反应(其中硅与稀硫酸不反应)测定通常状况(约20℃,1 atm)下气体摩尔体积的方法。拟选用下列实验装置完成试验:
(1)该组同学必须选用的装置的连接顺序是(用管口字母,可不填满):
A接()()接()()接()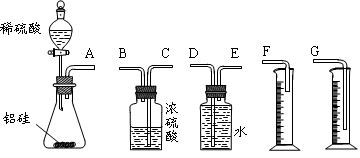
(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因_________________________。
(3)实验结束时,该组同学应怎样测量实验中生成氢气的体积?_______________。
(4)实验中准确测得4个数据:实验前铝硅合金的质量m1 g,实验后残留固体的质量m2 g,实验后量筒中液面读数为VmL。则通常状况下气体摩尔体积Vm=_________。若合金中含铜,测得的Vm将________(偏大/偏小/无影响)。
用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得到的有关过氧化钠跟水反应的结论是:第一,有氧气生成,第二,。Na2O2跟水反应的化学方程式是。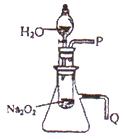
(2)某研究性学习小组拟用上图所示装置(气密性良好)进行实验,以证明上述结论。用以验证第一条结论的实验操作及现象是:。用以验证第二条结论的实验操作及现象是:。
(3)向试管中加水至固体完全溶解且不再有气泡生成后,取出试管,向试管中滴入酚酞试液,发现溶液先变红后褪色,为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有漂白性。
请设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在。(只要求写出实验所用的试剂及观察到的现象)
试剂:;
现象:。
(4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中是否含有H2O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论:
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用如图装置中的(忽略导管在量筒中所占的体积)(填A或B),理由是。
②若在标准状况下测量气体的体积,应选用的量筒的大小规格为(选填“100mL”、“200mL”、“500mL”或“1000mL”)
某同学想通过下图装置实验、探究SO2与Na2O2反应的产物。
(夹持装置已略去,装置的气密性良好)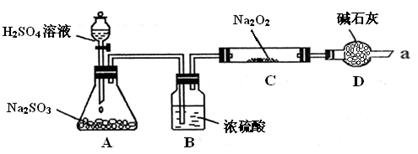
Ⅰ.装置B的作用是吸收水,干燥SO2气体,其原因是(用离子方程式表示)
。
装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是
。
Ⅱ.某同学想通过上图实验装置,检验反应中是否有O2生成时,其实验操作步骤是:
①先
②再用带火星的木条靠近干燥管口a,观察其是否复燃。
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3:。
(1)若假设2成立,写出所发生反应的化学方程式
。
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲设计如下实验:
得出结论:产物是Na2SO4。
该方案是否合理(填“是”或“否”)。
(3)设计实验验证假设3的实验步骤如下:
| 实验步骤 |
实验现象 |
| ①滴加入过量的稀盐酸 |
产生剌激性气味气体 |
| ②滴加入适量的BaCl2溶液 |
产生白色沉淀。 |
| ③取少量C中固体产物于试管中,加入适量的蒸馏水溶解 |
若假设3成立,正确的实验操作顺序是
某同学欲配制100mL0.20mol,L-1的KCl溶液,实验操作如下:
(A)用托盘天平准确称取1.49gKCl固体,并放入烧杯中;
(B)加入约30mL蒸馏水,用玻璃棒搅拌使其溶解,并恢复至室温;
(C)将KCl溶液由烧杯小心倒入100mL容量瓶中;
(D)然后往容量瓶中加蒸馏水,直到液面接近标线1-2cm处,轻轻摇动容量瓶并静置片刻后,改用胶头滴管滴加蒸馏水;
(E)使溶液凹面最低点恰好与刻度相切,把容量瓶盖好,上下翻转摇匀后装瓶。
(1)该学生操作中错误的是____ _____(填写编号)。
(2)下面哪些操作会导致所配的100mLO.20mol/L的KCl溶液浓度降低_ ___。
(A)容量瓶用蒸馏水洗涤三次直到洗净, (B)称量KCl固体时将砝码放在左盘
(C)未洗涤转移KCl溶液的烧杯, (D)转移KCl溶液时有KCl溶液溅出
(E)定容时仰视刻度线
(3)若用O.2mol,L-1的KCl溶液配制0.05mol,L-1的KCl溶液200.0mL,需要O.20mol,L-1的KCl溶液mL,
(4)已知在标准状况下1L水可以溶解VLHCl气体,此时所形成的溶液密度为ρg/mL,(相对原子质量Cl35.5 H 1),该溶液物质的量浓度为: (mol/L)