
Ⅰ.上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界,并画出金属和非金属的分界线,用阴影画出铁元素所在的族。
Ⅱ. A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)D元素在周期表中的位置是 ,画出B元素简单离子结构示意图 ,乙物质的电子式是
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是(用元素符号填写)
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是
(4)简述比较D与E金属性强弱的实验方法:
(5)E的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用)其反应方程式为
2,3-二氢呋为无色易挥发液体,有温和香味,微溶于水,常温下稳定,是抗肿瘤药物的中间体,也用于电子化学品和香料中,可由丙烯为原料合成: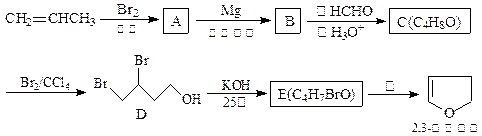
已知:
1、
2、
回答下列问题:
(1)请用系统命名法命名化合物D。
(2)①.反应③的条件是。
②.写出C、E的结构简式:C、E。
(3)工业上由化合物F(C4H10O2)在少量硫酸存在下可制得四氢呋喃,写出反应方程式:。
(4)写出满足下列条件的呋喃的一种同分异构体的结构简式。
① 没有支链,且一取代产物只有两种;
② 与银氨溶液不发生银镜反应。
(5)2,3-二氢呋喃在一定条件下可以转变成四氢呋喃,如何用简单的化学方法检验2,3-二氢呋喃是否完全转化?
近年来,随着我国经济的快速发展,对电力的需求越来越高,这也促进了我国电力工业高速发展,但我国电力结构中,火电比重非常大,占发电装机总容量的75%以上,且火电比重还在逐年上升。火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);ΔH1=-574kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g);ΔH2=-1160kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为:。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g);ΔH3
CH3OH(g)+H2O(g);ΔH3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如右图所示,则上述CO2转化为甲醇的反应的ΔH3 0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。下列说法正确的是 (填字母代号)。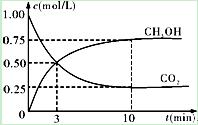
| A.第10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时c(CH3OH)=1.5mol·L-1 |
| B.0~10min内,氢气的平均反应速率为0.075mol/(L·min) |
| C.达到平衡时,氢气的转化率为0.75 |
| D.升高温度将使n(CH3OH)/n(CO2)减小 |
③甲醇碱性燃料电池工作时负极的电极反应式可表示为 。
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程式为: 。
(4)硫酸铵和硝酸铵的水溶液的pH<7,其中原因可用一个离子方程式表示为: ;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中:c(Na+)+c(H+) c(NO)+c(OH-)(填写“>”“=”或“<”)。
有10.2克镁铝合金恰好溶于250mL 4mol·L-1的盐酸中,现加入2mol·L-1的氢氧化钠溶液。请回答:
(1)要使产生的沉淀的质量最大,需加入的氢氧化钠溶液的体积是mL
(2)要使产生的沉淀只有氢氧化镁,至少需加入的氢氧化钠溶液的体积是mL
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
A 、 B 、 C、
F 、 H 、乙
(2)写出下列反应离子方程式:
反应①
反应③
反应⑤
反应⑥
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
。
(2)漂白粉的主要成分(填化学式)有效成分是(填化学式)。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方为。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号)。