Ⅰ.依据氧化还原反应:2Ag+(aq)+Cu(s) ===Cu2+(aq) +2Ag(s)设计原电池,请回答下列问题:
(1)负极材料是____________;电解质溶液是____________;
(2)正极发生的电极反应为________________________;
(3)电解质溶液中Ag+向_________极移动。
Ⅱ.一定温度下在某定容容器中发生反应:2A(g) +3B(g) ===2C(g),开始时,A的浓度为2 mol·L -1,B的浓度是4 mol·L-1,2 min后,A的浓度减少0.8 mol·L-1,则
(1)v(B) =___________,v(C) =____________。
(2)在2min末,C的浓度是____________,B的浓度是____________。
(1)将各有机物的序号填到对应分类中①CH3CH2CH3②CH2=CH—CH3 ③CH3COOCH3④H3C—OH⑤CH3CH2COOH醇:_______羧酸:_______ 烷烃: ______
⑥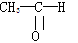 烯烃:_______酯:_______醛:_______
烯烃:_______酯:_______醛:_______
(2)如下图所示的核磁共振谱图是1-丙醇: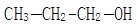 和2-丙醇:
和2-丙醇: 中的一种,根据图中信息,其结构简式为:
中的一种,根据图中信息,其结构简式为:
在浓硝酸中放入铜片:
①开始反应的化学方程式为。
②若铜有剩余,则反应将要结束时的反应的离子方程是:
③待反应停止后,再加入少量的25%的稀硫酸,这时铜片上又有气泡产生,其原因是。
有X、Y、Z三种元素:
①X、Y、Z的单质在常温下均为气体;
②X单质可以在Z的单质中燃烧,生成物为XZ,火焰呈苍白色;
③XZ极易溶于水,在水溶液中电离出X+和Z—,其水溶液能使蓝色石蕊试纸变红;
④每2个X2分子能与1个Y2分子化合成2个X2Y分子,X2Y常温下为液体;
⑤Z单质溶于X2Y中,所得溶液具有漂白性。
完成下列填空:
⑴试写出其元素符号:X_______,Y_______, Z_______,以及化合物的分子式:XZ_______,X2Y_________。
⑵写出Z单质与X2Y反应的化学方程式:。
⑶Z单质溶于X2Y中所得的新制溶液颜色为,该溶液具有漂白性是因为含有。
400 mL NaNO3和AgNO3的混合溶液中c(NO3—)=4mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到11.2L气体(标准状况),假设电解后溶液体积仍为400 mL。回答下列问题:
(1)把下列电极方程式补充完整:
阴极:、2H++ 2e-= H2
阳极:
(2)上述电解过程中转移电子的物质的量为。
(3)电解后溶液中的c(H+)为
按下图装置进行实验,并回答下列问题
(1)判断装置的名称:A池为
(2)锌电极反应式为__________________
石墨棒C1为______极,电极反应式为__________
石墨棒C2附近发生的实验现象为______________
(3)当C2极析出2.24L气体(标准状态)时,锌的质量减少了__g.CuSO4溶液的质量增加了______g