1,2—二溴 乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于有机溶剂,在实验室中可以用下图所示装置制备1,2—二溴乙烷。其中分液漏斗和烧瓶a中装有酒精和浓H2SO4的混合液,试管d中装有液溴(表面覆盖少量水)。填写下列空白:
乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于有机溶剂,在实验室中可以用下图所示装置制备1,2—二溴乙烷。其中分液漏斗和烧瓶a中装有酒精和浓H2SO4的混合液,试管d中装有液溴(表面覆盖少量水)。填写下列空白:
(1)写出实验中制备1,2—二溴乙烷的两个化学反应方程式 ,
。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象 。
(3)容器c中NaOH溶液的作用是__________________________________。
请填写下列空白
实验室有下列仪器: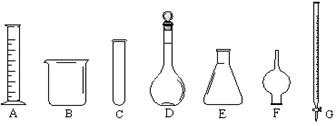
请从A~G中选择适当的装置填空(填字母)。
①有零刻度且在上方的是;
②需要垫上石棉网才可以加热的是;
③常盛放固体干燥剂,用以干燥气体的是。
实验室常用的几种气体发生装置如下图所示: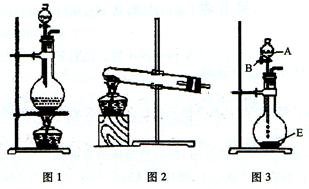
(1)现用两种方法来制取氧气,可供选用的药品有:KClO3、Na2O2、NaOH、H2O、Na2CO3、MnO2。
第一种方法是选择装置图2,则需选用的试剂为:______________________;第二种方法是选择装置图3,则需选用的试剂为:_____________________________。
(2)若把装置图1与装置图4相连,在实验室可用来制取下列气体中的_________(填序号)。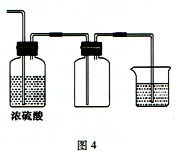

①CH2=CH2②NO ③Cl2 ④C2H2⑤NH3
制取这种气体时,除选用(1)所提供的几种药品外,还需要的一种试剂是___________。
(3)若把装置图3与装置图5相连,进行实验,将溶液A逐滴加入试剂E中;溶液恰好澄清时,关闭B,然后往烧杯中加入热水,静置片刻,观察到试管内壁出现光亮的银镜,则溶液A是 ___________(写名称),C是__________(写化学式)与乙醛(或葡萄糖)的混合液。该反应的离子方程式为_____________________,仪器D在此实验中的作用是__________________________。
侯德榜是我国著名的工业化学家,又是一个伟大的爱国者,他所发明的制碱法为中国化学工业乃至世界化学工业作出了重要的贡献,被誉为“侯氏制碱法”。请你回答以下问题:
(1)“侯氏制碱法”中的“碱”其实不是烧碱,请实际情况出向它的溶液中滴加少量稀盐酸的离子方程式____________________________________。
(2)某同学为了验证 和
和 的稳定性,设计了如图甲的实验装置(铁架台、夹持仪器、加热装置等已省略),你认为在X中应放的物质_____________________(填化学式)。
的稳定性,设计了如图甲的实验装置(铁架台、夹持仪器、加热装置等已省略),你认为在X中应放的物质_____________________(填化学式)。
(3)某化学研究性学习小组在老师的指导下,模拟侯德榜先生的制碱原理设计了如图乙的实验装置。
A.实验的操作步骤中,你认为打开旋塞 、
、 的合理顺序应为:先打开______,后打开________(填字母代号)。简述理由____________________________。
的合理顺序应为:先打开______,后打开________(填字母代号)。简述理由____________________________。
B.在盛饱和食盐水的装置中发生反应的离子方程式为________________________;能析出碳酸氢钠晶体的原因是_________(填序号)。
a. 碳酸氢钠难溶于水 b. 碳酸氢钠受热易分解
c. 碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
装置中气胆的作用是___________________________________________________。
C.工业上若需制备纯碱,则上述原料中除了饱和食盐水外,其他原料用工业常用方法制取,写出工业制备两种原料气的主要化学反应方程式__________________。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法:___________________________。
(5)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:原子利用率(%)=_______________。
某化学兴趣小组模拟测定 、
、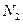 、
、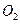 混合气体中
混合气体中 的体积分数,下图是它们在测定中使用的部分实验装置:
的体积分数,下图是它们在测定中使用的部分实验装置:
(1)在答卷的方框中画出所缺实验装置(含试剂)。
(2)当装置①出现________________________现象时,应立即停止通气。若此时没有及时停止通气,则测定的 体积分数_____________(填“偏高”、“偏低”或“不受影响”);若通入气体速度过快,则测定的
体积分数_____________(填“偏高”、“偏低”或“不受影响”);若通入气体速度过快,则测定的 体积分数__________(填“偏高”、“偏低”或“不受影响”)
体积分数__________(填“偏高”、“偏低”或“不受影响”)
(3)装置①中发生反庆的离子方程式为____________________________。
(4)你认为下列试剂中,可以用来代替试管中碘的淀粉溶液的是________(填编号)
A.酸性 溶液 溶液 |
B.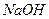 溶液 溶液 |
C.溴水 | D.氨水 |
(5)若碘溶液的浓度为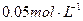 、体积为10mL,收集到的
、体积为10mL,收集到的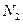 和
和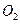 的体积为148.8mL(已折换为标准状况下的体积),
的体积为148.8mL(已折换为标准状况下的体积), 体积分数为___________。
体积分数为___________。
某研究小组在查阅资料中发现,常温下氯气可以氧化氨气获得氮气。该小组由此设计出制取氮气的思路,设计装置图如下。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置A中的烧瓶内固体不可以选用_________(填序号)。
A.生石灰 B.碱石灰 C.五氧化二磷 D.烧碱
(2)装置F发生反应的离子方程式是___________________________。
(3)B装置的作用_________;E装置的作用__________________。
(4)写出制取 的化学方程式__________________;反应生成
的化学方程式__________________;反应生成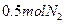 ,转移的电子数是_________
,转移的电子数是_________ 。
。
(5)当反应装置里的氨气和氯气的物质的量之比大于_________时,尾气里一定含有氨气;当反应装置里的氯气和氨气的物质的量之比大于_________时,尾气里一定含有氯气。