若X、Y两种元素在周期表中位于同一主族,且相隔一个周期,并有m=n>0。在一定条件下有下列反应(未配平):Xm + Yn + H2O → HXO3 + HY。请回答:
⑴该反应的还原剂的电子式为___________________。
⑵配平上述化学方程式(用化学式表示):
⑶若某化学反应如下:(未配平)KX + Yn + H2O → KXO3 + Xm + HY + KY
若KXO3和Xm的化学计量数均为1,则Yn的化学计量数为____________。
在下面化学式上标出电子转移的方向和数目:
KX + Yn + H2O →
⑷已知:在反应中,若氧化反应和还原反应发生在同一分子内部处于同一化合价的同种元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原。这种自身的氧化还原反应称为歧化反应。实验室模拟KXO3的制法如下:
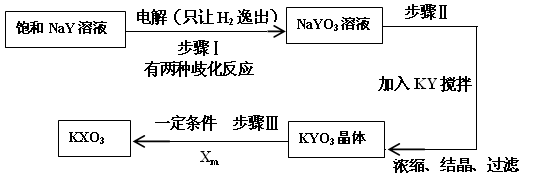
①在进行步骤Ⅰ实验时,有学生主张电解装置用U形管,有的学生主张用烧杯,你认为用哪种仪器更合适______________(填名称)。
②步骤Ⅰ的阴极电极反应式为(用化学式表示):_____________________。
③步骤Ⅰ中生成NaYO3的歧化反应的离子方程式为(用化学式表示):______________________。
④步骤Ⅱ中向NaYO3的溶液中加入粉末状的KY,搅拌后生成KYO3。已知有2L 3 mol·L-1的NaYO3溶液,则至少需要加入__________mol KY粉末可将溶液中的YO3-离子沉淀至浓度变为0.1 mol·L-1。[已知Ksp(KYO3)= 0.366,计算结果保留两位小数,加入KY粉末后溶液体积不变]
有下列几组物质:
A. H和 H和 H H |
| B.甲烷和己烷 |
| C.正丁烷和异丁烷 |
D. 和 和 |
E. 和
和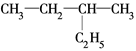
其中,①属于同分异构体的是________;②属于同位素的是________;③属于同一种物质的是________;④属于同系物的是________________。
(一)、将2 mol SO2和1 mol O2气体在1L的容器中混合,在一定条件下发生如下反应:2SO2(g)+O2 (g)  2SO3 (g)。若经过2s后测得SO3的浓度为0.6 mol/ L。试计算:(1)O2的化学反应速率V(O2)=; (2)2s时的O2浓度。
2SO3 (g)。若经过2s后测得SO3的浓度为0.6 mol/ L。试计算:(1)O2的化学反应速率V(O2)=; (2)2s时的O2浓度。
(二)、某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如下图所示。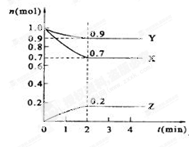
(1)X的转化率是
(2)由图中所给数据进行分析,该反应的化学方程式为;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=;
(4)当反应进行到第min,该反应达到平衡。
同学们已经学习了几种典型的有机化学反应类型——取代反应、加成反应,请写出下列反应的化学方程式,并判断其反应类型。
(1)由甲烷制取CH3Cl:_________________________________,属于________反应。
(2)由苯制取硝基苯:__________________________________,属于________反应。
(3)由苯制取环己烷:__________________________________,属于________反应。
电解原理在工业中有广泛应用。右图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: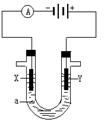
(1)若X、Y是惰性电极,a是200mLNaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则电解池中X极上的电极反应为_____,在X极附近观察到的现象是 :_______。Y电极上的电极反应式是_________,检验该电极反应产物的方法是 :________________。当外电路通过0.02 mol电子时,充分混合电解后的溶液,忽略溶液体积变化,理论上溶液的PH值为_______。
(2)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是_________,Y电极的材料是______,Y电极反应式是_______________。
已知电极材料:铁.铜.银.石墨.锌.铝,电解质溶液:氯化铜溶液.硫酸铁溶液.盐酸。按要求回答下列问题:
(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用,请说明原因。__________。
(2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线构成原电池,请写出电极反应式,负极,正极。
(3)若总反应为:Cu+2H+= Cu2++H2,判断该装置属于原电池还是电解池?____。画出对应的装置图,标出电极材料和电解质溶液。_____