到目前为止,由化学能转变为热能或电能仍然是人类使用最主要的能源。
(1)化学反应中放出的热能(焓变,ΔH)与反应物和生成物在反应过程中断键和形成新键过程中吸收和放出能量的大小有关。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH=-185 kJ/mol,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为 。
(2)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
②C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③ 2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
标准状态下22.4 L氢气和甲烷的混合气体在足量的氧气中充分燃烧反应放出588.05 kJ的热量,原混合气体中氢气的质量是 。根据以上三个热化学方程式,计算C(s,石墨)+2H2(g)=CH4(g)的反应热ΔH为 。
芳香族化合物C的分子式为C9H9OCl。C分子中有一个甲基且苯环上只有一条侧链;一定条件下C能发生银镜反应;C与其他物质之间的转化如下图所示:
(1)F中含氧官能团的名称是;B→A的反应类型是。
(2)H的结构简式是。
(3)写出下列化学方程式:D与银氨溶液反应。
(4)有的同学认为B中可能没有氯原子,你是__________(填“同意”或“不同意”),你的理由是。
(5)D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件W的同分异构体有________种,写出其中核磁共振氢谱有4个峰的结构简式____________。
①属于芳香族化合物
②遇FeCl3溶液不变紫色
③能与NaOH溶液发生反应但不属于水解反应
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务。
(1)汽车内燃机工作时发生反应:N2(g) + O2(g)  2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol。
① 5 min内该反应的平均速率υ(NO) = ;在T ℃时,该反应的平衡常数K = 。
② 反应开始至达到平衡的过程中,容器中下列各项发生变化的是(填序号)。
a. 混合气体的密度 b. 混合气体的压强
c. 正反应速率 d. 单位时间内,N2和NO的消耗量之比
(2)H2或CO可以催化还原NO以达到消除污染的目的。
已知:N2(g) + O2(g) = 2NO(g)H =" +180.5" kJ·mol-1
2H2(g) + O2(g) = 2H2O(l)H = -571.6 kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是。
(3)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应:2NO(g) + 2CO(g) 2CO2(g) + N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
① 该反应的H0 (填“>”或“<”)。
② 若催化剂的表面积S1>S2 ,在下图中画出c(NO) 在T1、 S2条件下达到平衡过程中的变化曲线。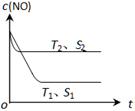
原子序数小于36的X、Y、Z、W四种元素,其X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题: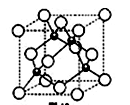
1)Y2X2分子中Y原子轨道的杂化类型为,1mol Y2X2含有σ键的数目为。
2)化合物ZX3的沸点比化合物YX4的高,其主要原因是。
3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是。
4)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是,它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为。
氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示: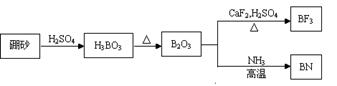
请回答下列问题:
1)由B2O3制备BF3、BN的化学方程式依次是、;
2)基态B原子的电子排布式为;B和N相比,电负性较大的是,BN中B元素的化合价为;
3)在BF3分子中,F-B-F的键角是,B原子的杂化轨道类型为,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为;
4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为,层间作用力为;
5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有个氮原子、个硼原子,立方氮化硼的密度是g/cm3(只要求列算式,不必计算出数值。阿伏伽德罗常数为NA)。
下表为长式周期表的一部分,其中的编号代表对应的元素。
根据上述表格中的十种元素填空:
1)表中属于ds区的元素是(填编号)。
2)元素②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨。有关该化合物分子的说法正确的是。
| A.分子中含极性共价键 | B.含有1个σ键和2个π键 |
| C.属于非极性分子 | D.该化合物分子中,②原子采用sp2杂化 |
3)金属性最强的主族元素是(填元素名称)。
4)⑤、⑥、⑦的离子半径由小到大的顺序是(填化学式)。
5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的未成对电子数为个; 该元素与元素①形成的分子X的空间构型为。