相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)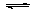 2NH3(g) △H=一92.6kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g) △H=一92.6kJ/mol。实验测得起始、平衡时的有关数据如下表:
| 容器 |
起始各物质的物质的量/mol |
达平衡时体系能量的变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量:23.15kJ |
| ② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述不正确的是( )
| A.容器①、②中反应的平衡常数相等 |
| B.平衡时,两个容器中NH3的体积分数均为1/7 |
| C.容器②中达平衡时放出的热量Q=23.15kJ |
| D.若容器①体积为0.5L,则平衡时放出的热量小于23.15kJ |
由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是 ( )
| A.②④⑤③① | B.③②④①⑤ | C.③④②⑤① | D.②④③⑤① |
向Na2CO3溶液中逐滴加入稀盐酸,直到不再生成CO2气体为止。在此过程中,HCO3—离子浓度变化趋势是( )
| A.逐渐变小 | B.逐渐增大 |
| C.先增大后减少 | D.先减少后增大 |
下列说法正确的是 ( )
| A.为检验某Na2SO3溶液中是否有部分变质成Na2SO4,可选用氯化钡溶液。 |
| B.为鉴别某气体是CO2还是SO2,可选用澄清石灰水。 |
| C.为鉴别某溶液是Na2CO3溶液还是NaHCO3溶液,可选用澄清石灰水。 |
| D.为鉴别某溶液是MgCl2还是AlCl3,可选用NaOH溶液。 |
下列关于氯水的叙述不正确的是 ( )
| A.氯水滴加到AgNO3溶液中会产生白色沉淀 |
| B.氯水通常应在阴凉处置于棕色细口瓶中密封保存 |
| C.新制氯水可使蓝色石蕊试纸先变红后褪色 |
| D.新制氯水放置数天后溶液的酸性减弱 |
0.1mol某元素的单质直接与足量氯气反应,质量增加7.1g,这种元素可能是
( )
| A.Na | B.Al | C.Fe | D.Cu |