Ⅰ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA的浓度/(mol/L) |
NaOH的浓度/(mol/L) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1)不考虑其它的实验结果,单从甲组情况分析,若a 7(填“>”、“<”或“=”)则HA为弱酸;
(2)不考虑其它组的实验结果,仅从乙组情况分析,则下列叙述一定错误的是
| A.酸溶液的物质的量浓度大于碱溶液 |
B.酸溶液中H+的浓度大于碱溶液中O H-的浓度 H-的浓度 |
| C.酸溶液的物质的量浓度小于碱溶液 |
| D.酸溶液中H+的浓度小于碱溶液中OH-的浓度 |
E.两种溶液的物质的量浓度相等
(3)从丙组实验结果分析,HA是 酸(填“强”或“弱”)。若此时10mL0.5mol/LNaA溶液与6mL1mol/L盐酸混合后,溶液中除OH—外的各离子浓度由大到小顺序为 ;
(4)丁组实验所得混合溶液中由水电离出来的c(OH—)= mol/L。
(5)假设HA是一元弱酸,而难溶物CaA2在水中存在溶解平衡:CaA2(s)  Ca2++2A-
Ca2++2A-
△H>0,一定温度下CaA2饱和溶液中Ksp=c(Ca2+)c2(A2-)为一常数。
①温度升高时,Ksp (填“增大”、“减小”或“不变”)。
②测得25℃时,CaA2的Ksp为4.0×10-11,常温下将10g CaA2固体投入100mLCaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1mol/L,则溶液中c(A2-)= 。
Ⅱ、平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。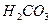

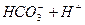
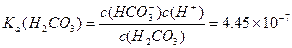
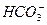


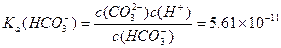
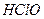

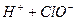
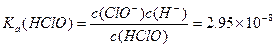
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
(1)将少量的氯气通入到过量的碳酸钠溶液中___ _____________;
(2)氯气和碳酸钠按照1︰1的物质的量之比恰好反应_______________________________;
研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)高湿条件下,写出大气中SO2转化为HSO3-的方程式: 。
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为 。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:
①质子的流动方向为 (“从A到B”或“从B到A”)。
②负极的电极反应式为 。
(4)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如下:
①用纯碱溶液吸收SO2将其转化为HSO3-,反应的离子方程式是 。
②若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是 。
大气中的部分碘源于O3对海水中I¯的氧化。某科学小组进行O3与含I¯溶液反应的相关研究。
(1)O3将I¯氧化生成I2的过程由3步反应组成:
① I¯(aq)+ O3(g)="==" IO¯(aq)+O2(g)△H1
② IO¯(aq)+H+(aq) HOI(aq)△H2
HOI(aq)△H2
③ HOI(aq) + I¯(aq) + H+(aq) I2(aq) + H2O(l)△H3
I2(aq) + H2O(l)△H3
用热化学方程式表示O3氧化I¯生成I2的反应____________________。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半时所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216 mol/L。
 |
3.0 |
4.0 |
5.0 |
6.0 |
| 20 |
301 |
231 |
169 |
58 |
| 30 |
158 |
108 |
48 |
15 |
| 50 |
31 |
26 |
15 |
7 |
① 在30℃、pH=4.0条件下,O3的分解速率为__________mol/(L·min)。
② pH增大能加速O3分解,表明对O3分解起催化作用的是___________。
③ 根据表中数据,推测O3在下列条件下分解速率依次增大的顺序为_________(填字母代号)。
a.40℃、pH=3.0 b.10℃、pH=4.0 c.30℃、pH=7.0
(3)I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq)。测得不同温度下该反应的平衡常数如图1所示,下列说法正确的是_____________。
I3-(aq)。测得不同温度下该反应的平衡常数如图1所示,下列说法正确的是_____________。
A.反应I2(aq)+I-(aq)  I3-(aq)的ΔH>0
I3-(aq)的ΔH>0
B.利用该反应可以除去硫粉中少量的碘单质
C.在上述平衡体系中加入苯,平衡不移动
D.25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680

图1图2
(4)将I2溶于CCl4中,得到紫红色的溶液,再加入一定浓度的KI溶液,现象如图2所示:
①上层溶液中含碘元素的微粒有____________________(用化学符号表示)。
②由实验现象可推测关于I2溶解性的结论是_________________________。
铝及其化合物用途广泛,研究其性质具有重要意义。
(1)铝离子的结构示意图为 。
(2)美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺,过程如图1所示:

图1图2
① 铝镓合金与水反应的化学方程式为______________________。
② 该工艺过程中,能量的转化形式分别有_______________(填“什么能转变为什么能”)。
③ 该工艺过程总反应的实质是_____________________。
(3)室温下,往0.2 mol/LAl2 ( SO4)3溶液中逐滴加入1.0 mol/L NaOH溶液,实验测得溶液pH随NaOH溶液体积变化的曲线如图2所示。解释c→d过程中pH增大且幅度较大的原因(请结合必要的化学用语)_____________________。
知识的梳理和感悟是有效学习的方法之一。某学习小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(显示的电极均为石墨)。

(1)图1中,电解一段时间后,气球b中的气体是___________(填化学式),U形管__________(填“左”或“右”)边的溶液变红。
(2)利用图2制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分,则c为电源的________极;该发生器中反应的总离子方程式为___________________。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质传输与转化关系如图3所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。
图3
①燃料电池B中的电极反应式分别为:负极_______________,正极______________。
②分析图3可知,氢氧化钠的质量分数a%、b%、c%由大到小的顺序为___________。
高分子化合物PTT是一种性能优异的新型纤维,是当前国际上最新开发的热门高分子新材料。PTT的一种合成路线如下图:

(1)已知A→B是加成反应,B的结构简式为______________,C分子中含有的官能团是_____________。
(2)用系统命名法给有机物D进行命名_______________________________。
(3)芳香烃E的相对分子质量为106,E的一氯代物只有2种,则E的结构简式为___________。
(4)E→F的反应类型为________反应,合成PTT的化学方程式为____________。
(5)有机物I的同分异构体有很多种,写出同时符合下列条件的所有同分异构体的结构简式_____________。
①含有苯环 ②核磁共振氢谱有三个峰