(8分)某化学课外小组用海带为原料制取了少量碘水。现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
| A.把盛有溶液的分液漏斗放在铁架台的铁圈中; |
| B.把50 mL碘水和15 mL CCl4加入分液漏斗中,并盖好玻璃塞; |
| C.检验分液漏斗活塞和上口的玻璃塞是否漏液; |
| D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; |
(E)旋开活塞,用烧杯接收溶液:
(F)从分液漏斗上口倒出上层水溶液;
(G)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
(H)静置,分层。
就此实验,完成下列填空。
(1) 正确操作步骤的顺序是:(用上述各操作的编号字母填写)
_____® _____® _____® A ® G ® _____ ® E ® F
(2) 上述(E)步骤接收溶液时应注意
(3) 能选用CCl4从碘水中萃取碘的原因是
实验室从含碘废液(除
外,含有
、
、
等)中回收碘,其实验过程如下:
(1)向含碘废液中加入稍过量的
溶液,将废液中的
还原为
,其离子方程式为;该操作将
还原为
的目的是。
(2)操作X的名称为。
(3)氧化时,在三颈烧瓶中将含
的水溶液用盐酸调至pH约为2,缓慢通入
,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是;锥形瓶里盛放的溶液为。
(4)已知: 某含碘废水(pH约为8)中一定存在 ,可能存在 、 中的一种或两种。请补充完整检验含碘废水中是否含有 、 的实验方案:取适量含碘废水用 多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在;
。
实验中可供选择的试剂:稀盐酸、淀粉溶液、
溶液、
溶液
硫代硫酸钠(
)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应:
制得。实验室模拟该工业过程的装置如图所示。
回答下列问题:
(1)b中反应的离子方程式为,c中试剂为。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是。
(3)d中的试剂为。
(4)实验中要控制
生成速率,可以采取的措施有(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的
,不能过量,原因是。
碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置
,在高温下x克钢样中碳、硫转化为
、
。
①气体
的成分是。
②若钢样中硫以
形式存在,
中反应:
高温1+3。
(2)将气体
通入测硫酸装置中(如右图),采用滴定法测定硫的含量。
①
氧化
的化学方程式:。
②用
溶液滴定生成的
,消耗z mL
溶液,若消耗1mL
溶液相当于硫的质量为
克,则该钢样中硫的质量分数:。
(3)将气体
通入测碳装置中(如下图),采用重量法测定碳的含量。

①气体
通过
和
的目的是。
②计算钢样中碳的质量分数,应测量的数据是。
分某同学为探究铜跟浓硫酸的反应情况,用下图所示装置进行了有关实验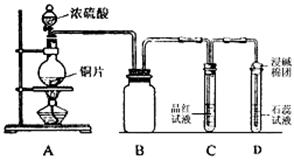
(1)B是用来收集实验中生成的气体的装置,但未将导管画全,请在答题卷上把导管补充
完整。
(2)请写出铜跟浓硫酸反应的化学方程式。
(3)实验中D中的现象。
(4)实验中,该同学取6.4g铜片和12mL 18mol·L-1H2SO4溶液放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余;该同学根据所学的化学知识判断还会有一定量H2SO4的剩余,下列药品中能够用来验证反应停止后的烧瓶中确有剩余的H2SO4的是填字母编号)。
a.BaCl2溶液 b.Ba(NO3)2溶液 c.银粉 d.Na2CO3粉末
(5)若将16g铜与50mLH2SO4物质的量浓度为一定值的浓硫酸反应,铜完全溶解。请回答:
①反应中产生的气体在标准状况下的体积为L。
②该反应中被还原的H2SO4的物质的量为mol。
③待产生的气体全部释放后,向溶液中滴加VmL a mol·L-1NaOH溶液,恰好使溶液中
的Cu2+全部转化为沉淀,则原浓硫酸中H2SO4的物质的量浓度=mol·L-1。
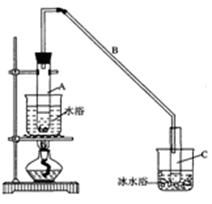
某化学小组采用类似制乙酸乙酯的装置(如下图),以环己醇制备环己烯
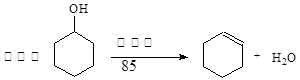
| 密度(g/cm3) |
熔点(℃) |
沸点(℃) |
溶解性 |
|
| 环己醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
(1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是 ,导管B除了导气外还具有的作用是 。
②试管C置于冰水浴中的目的是 。
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在 层(填上或下),分液后,用 (填编号)洗涤环己烯。
A.KMnO4溶液 B.稀H2SO4C.Na2CO3溶液 D.NaOH溶液
②再将环己烯按下图装置蒸馏,冷却水从 (填f或g)口进入,蒸馏时要加入生石灰,目的是 。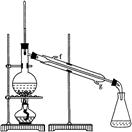
③收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 。
A.蒸馏时从70℃开始收集产品 B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,最简单的方法是 。
A.酸性KMnO4溶液 B.用金属钠 C.测定沸点 D.溴的四氯化碳溶液