已知A是一 种烃类,其相对分子量为56,1molA与氧气充分燃烧后生成4molCO2。
种烃类,其相对分子量为56,1molA与氧气充分燃烧后生成4molCO2。
从化合物A出发有以下转化关系:
根据以上信息,回答以下问题:
(1)化合物A的分子式为 ,结构简式为 。
,结构简式为 。
(2)反应②的化学方程式为: ;
属于 (反应类型)。
(3)反应③的化学方程式为: ;
属于 (反应类型)。
(4)化合物B一定条件下可以与氢气发生加成反应,1molB最多可以消耗 molH2 ,请写出该反应化学方程式: 。
①A、B两种物质都是由H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合,要求A1的溶液中水的电离程度小于A2溶液中水的电离程度,B1溶液中水的电离程度小于B2溶液中水的电离程度。
(1)写出化学式A1________ B2_______;
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的H+的物质的量浓度之比为_____________;
(3)若B1、B2两溶液的pH = 5,则两溶液中水电离的H+的物质的量浓度之比为______。
② 25℃时用Pt电极电解500mL amol/L CuSO4溶液,试回答下列有关问题:
(1)写出阳极的电极反应式: ____________;
(2)当电解到C(Cu2+)为0.5a mol/L时,停止电解,若要使溶液恢复到与电解前相同的状态,可向溶液中加入适量的____________。
A.CuSO4粉末 B.CuSO4·5H2O C.CuO粉末 D.Cu(OH)2
阿扎西隆(azasetron)适用于治疗由服用药物引起的恶心、呕吐等消化道症状。文献资料显示,它可由水杨酸甲酯(a)为原料合成,部分合成路线如下: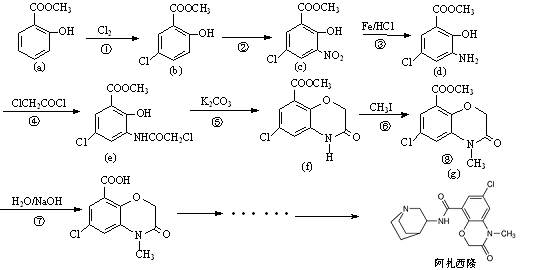
试回答下列问题:
(1)填写反应类型:反应③、反应④;
(2)反应②的试剂是:;
(3)水杨酸甲酯(a)的同分异构体中,能与碳酸氢钠溶液放出二氧化碳,再加入氯化铁溶液又显紫色有多种,写出其中一种的结构简式;
(4)水杨酸甲酯是水杨酸(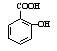 )与甲醇形成的酯,请写出该反应的化学方程式。
)与甲醇形成的酯,请写出该反应的化学方程式。
(1)质量都为3 g的镁和铝,物质的量之比为;将它们分别放入适量的盐酸溶液中恰好完全反应,则消耗的盐酸的物质的量之比为。
(2)在50 mL NaNO3和Na2SO4的混合溶液中,c (Na+) =" 1" mol/L,往其中加入50 mL BaCl2溶液恰好完全反应,后得到2.33 g白色沉淀,则原混合溶液中c (NO3-)=mol/L。
(3)已知Cu3P中P为 -3价,在反应 11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,①被氧化的P和被还原的P的物质的量之比为;
②当有8 molH2O参加反应,上述反应转移的电子数目约为个;
③上述反应中7.5 mol CuSO4氧化的P原子的物质的量为。
在四个无标签的试剂瓶中,分别盛有盐酸、Ba(OH)2 溶液、Na2CO3溶液、AgNO3
溶液。为了确定各瓶试剂,将它们分别编号为A、B、C、D,分别取样两两混合,其实验现象为:
A+B→无色气体 B+C→白色沉淀 A+D→白色沉淀 A+C→无明显现象
(1)由此推断各试剂瓶中所盛试剂为(填化学式)
A:B:C:D:
(2)写出下列反应的离子方程式
①A+C:
②A+D:
某次实验需用480 mL、0.5 mol/L 的稀H2SO4溶液,某同学用98%的浓H2SO4 (ρ="1.84" g/cm3)进行配制,请回答下列问题:
(1)98%的浓H2SO4(ρ="1.84" g/cm3)的物质的量浓度为
(2)将下列步骤中的空格内将所用仪器补充填写完整
①用20 mL量筒量取所需的浓硫酸
②将烧杯中的溶液转移到mL的容量瓶中
③将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌
④将溶液冷却,恢复室温
⑤向容量瓶中加入蒸馏水,在距离刻度1~2 cm时,改用加蒸馏水至刻度线
⑥盖好瓶塞,反复上下颠倒,摇匀
⑦洗涤烧杯2~3次,洗涤液也注入容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
(3)实验中上述步骤的正确顺序为(填序号)。
(4)在横线上填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”)。
①所用的浓硫酸长时间放置在密封不好的容器中
②量取浓硫酸所用量筒有蒸馏水
③定容时,俯视液面