A—J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。
回答下列问题: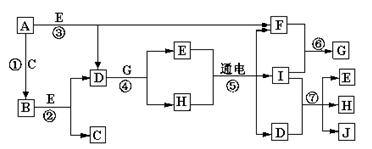
(1)B中的化学键有 ,(填“离子键”、“极性键”或“非极性键”)E的电子式 。
(2)写出反应⑦的离子方程式 _______ ___________________。
___________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式_____________________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在_____________(填“阴或阳”)极附近溶液由无色变为红色,其原因是 。
“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101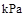 时:
时: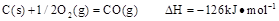
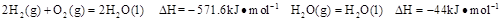
则在25℃,101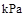 时:
时: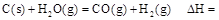 .
.
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为: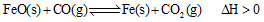 ,已知在1100℃时,该反应的化学平衡常数K=0.263。
,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的 平衡,此时平衡常数K值(填“增大”、“减小”或“不变”);
平衡,此时平衡常数K值(填“增大”、“减小”或“不变”);
②1100℃时测得高炉时,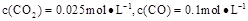 ,在这种情况下,该反应是否处于化学平衡状态?(填“是”或“否”),其判断依据是。
,在这种情况下,该反应是否处于化学平衡状态?(填“是”或“否”),其判断依据是。
③目前工业上可用 来生产燃料甲醇
来生产燃料甲醇 ,有关反应为:
,有关反应为: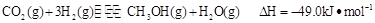 。现向体积为1L的密闭容器中,充入1mol
。现向体积为1L的密闭容器中,充入1mol 和3mol
和3mol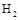 ,反应过程中测得
,反应过程中测得 和
和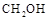 (g)的浓度随时间的变化如图所示。
(g)的浓度随时间的变化如图所示。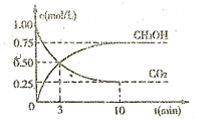
①从反应开始到平衡,氢气的平均反应速率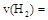 ;
;
②下列措施能使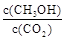 增大的是
增大的是 (填符号)。
(填符号)。
| A.升高温度 |
B.再充入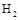 |
C.再充入 |
D.将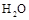 (g)从体系中分离 (g)从体系中分离 |
E.充入He(g),使体系压强增大
以硫 铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: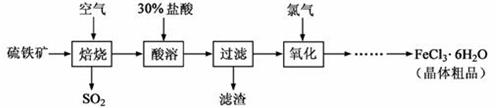
回答下列问题:
(1)将煅烧黄铁矿的化学方程式补充完整:+ Fe2O3+ SO2↑;该反应中,FeS2为 剂;SO2为 产物,其常常用于制备硫酸,反应过程中的化学反应方程式为 、 ;
Fe2O3+ SO2↑;该反应中,FeS2为 剂;SO2为 产物,其常常用于制备硫酸,反应过程中的化学反应方程式为 、 ;
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 ;
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;
(4)该过程产生的污染空气的气体有三种,尾气均可用强碱溶液吸收,这些反应的离子方程式为 ;。
(5)从FeCl3溶液中得到FeCl3.6H2O晶体的操作为 。
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高 的金属元素。
的金属元素。
回答下列问题:
⑴M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
⑵ Z、X两元素按原子数目比l:3构成分子A,A的电子式为_________;Y、L两元素按原子数目比l:2构成分子B,B的结构式为____________,B分子中的化学键属于_______键。
⑶硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子结构示意图为_______,其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 kJ·mol·L-1b.+29.7 kJ·mol·L-1
c.-20.6 kJ· mol·L-1d.-241.8 kJ·mol-1
⑷用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R。写出在阳极生成R及一种气体的电极反应式:_________________;
R受热分解生成化合物Q,由R生成Q的化学方程式:______________________;生成化合物Q的用途________、_____(写两种)。
现有NaCl、Na2SO4、NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀和固体,从而实现阴离子的分离。相应的实验过程可用下图所示:
请回答下列问题:
⑴写出实验流程中下列物质的化学式:试剂X :,沉淀A:,沉淀B:。
⑵上述实验流程中加入过量的Na2CO3的目的是。
⑶按此实验方案得到的溶液3中肯定含有(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的,之后若要获得固体NaNO 3需进行的实验操作是(填操作名称)。
3需进行的实验操作是(填操作名称)。
用双线桥表示下列反应中得失电子的情况,并指明氧化剂、还原剂、氧化产物、还原产物:
3FeO + 10HNO3 ="==" 3Fe(NO3)3+ NO↑ + 5H2O
()()()()
其中,氧化性:__________ > ___________;还原性:___________ > ___________