甲、乙分别是两种主族元素形成的氧化物,它们广泛存在于地壳中,均不溶于水,且都有如下相 同的转化关系,不同之处是乙对应的转化过程中需控制盐酸用量,若盐酸过量则得不到白色沉淀B。
同的转化关系,不同之处是乙对应的转化过程中需控制盐酸用量,若盐酸过量则得不到白色沉淀B。
(1) 写出甲、乙的化学式:甲________,乙________;
(2) 写出下列反应的化学方程式:
甲+NaOH溶液____________________________________________,
乙+NaOH溶液____________________________________________;
(3) 分别写出甲、乙对应的A溶液与过量盐酸反应的离子方程式:
甲 ________________________________________
乙______________ ______________________________
______________________________
(4) 若将5.1g乙溶于适量的盐酸(二者恰好完全反应)后,再加入175 mL的2 mol.L-1 NH3H2O溶液,得到沉淀___________g
下表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ):
| 物质 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
| 能量(kJ) |
243 |
193 |
151 |
432 |
366 |
298 |
436 |
根据上述数据回答下列问题:
(1)下列物质本身具有的能量最低的是。
A.H2B.Cl2 C.Br2 D.I2
(2)X2+H2 2HX (X代表Cl、Br、I)的反应是放热反应还是吸热反应?
2HX (X代表Cl、Br、I)的反应是放热反应还是吸热反应?
(3)相同条件下,X2 (X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是。
(4)若无上表中的数据,你能回答问题(3)吗?(回答“能”或“不能”)。你的依据是。
经验表明,除氢和氦外,当元素原子的电子层数(n)多于或等于原子最外层电子数(m)时,该元素属于金属元素;当元素原子的最外层电子数(m)多于电子层数(n)时,该元素属于非金属元素,其数学表达式为n≥2;(n-m)≥0时是金属元素;(n-m)<0时是非金属元素。试回答以下问题:
(1)第n周期有种主族金属元素。有种非金属元素。
(2)第m主族有种非金属元素。
(3)根据以上规则,预言未来发现的第七周期元素中,有种非金属元素,其理由是。
在某体积为2L的密闭容器中充入1.5mol NO2和2mol CO,在一定条件下发生反应: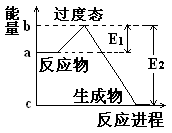
NO2+CO CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:
CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:
(1)此段时间内,用CO2表示的平均反应速率为。
(2)2 min时,容器内气体的总物质的量为。
(3)假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量(填“大于”、“小于”或“等于”)2 min时容器内气体的总物质的量。
原电池是一种________________________装置。电子表所用的某种钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应式为:
Zn+2OH--2e-=ZnO+H2O Ag2O+H2O+2e-=2Ag+2OH-
电池的负极是____________,正极发生的是____________反应(填反应类型),总反应式为___________________________________。
(1)写出下列物质的电子式: HClO
(2) 用电子式表示下列物质的形成过程:MgCl2