(6分)⑴在①NaCl、②NaOH、③N2、④H2S、⑤Na2O2中,只含有离子键的是 ,只含有极性键的是 ,既含离子键又含非极性共价键的是 。
(2)写出下列物质的电子式:
CO2 NaCl HClO
22、(9分)依据事实,写出下列反应的热化学方程式。
(1)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O。 放出571.6kJ的热量,表示H2燃烧的热化学方程式为____________。
(2)在25℃、101kPa下,1g甲醇液体燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_______________________________________
(3)已知:已知:C(s)+O2(g)=CO2(g) ΔH="-437.3" kJ·mol一1
H2(g)+  O2(g)=H2O(g) ΔH="-285.8" kJ·mol一1
O2(g)=H2O(g) ΔH="-285.8" kJ·mol一1
CO(g)+  O2(g)=CO2(g) ΔH="-283.0" kJ·mol一1
O2(g)=CO2(g) ΔH="-283.0" kJ·mol一1
则煤的气化主要反应(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式是________________
21.有下列3种有机化合物A:CH2=CH2B: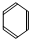 C:CH3COOH
C:CH3COOH
(1)写出化合物A、C中官能团的名称、______________;
(2)3种化合物中能使溴的四氯化碳溶液褪色的是(写名称);反应的化学方程为:;具有特殊气味、常做有机溶剂的是(写名称)。
(3)3种化合物中能与NaOH发生中和反应的是(写名称)。
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。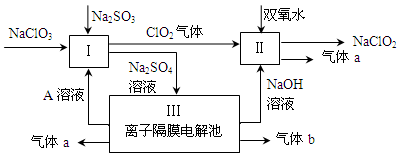
(1)Ⅰ、Ⅲ中发生反应的还原剂分别是、(填化学式)。
(2)Ⅱ中反应的离子方程式是。
(3)A的化学式是,装置Ⅲ中A在极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该制备反应的化学方程式。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量。(填“相同”,“不同”或“无法判断”)
(9分)氮及其化合物在很多方面有重要的用途。
(1)氮的氧化物有多种。现有NO和NO2的混合气体,其中N 、O元素质量之比为7:12,则该混合气中NO和NO2的物质的量之比为 。
(2)氨气的实验室制法有多种,若不加热,制取氨气所用试剂可以用浓氨水和生石灰,产生氨气的原因是:;氨气的检验方法是:。
(3)硝酸具有很强的氧化性,王水是浓硝酸与浓盐酸的混合液,可以溶解金、铂等金属。铂溶于王水时产生[PtCl6] 2-和一种无色气体,该气体遇空气变为红棕色,写出该反应的离子方程式。
(4)氮的一种氢化物肼(即N2H4)用作发射卫星的燃料。
已知: N2 + 2O2 = 2NO2 N2H4 + O2 = N2 + 2H2O
发射卫星用气体肼为原料,以NO2为氧化剂,两种物质反应生成氮气和水蒸气,反应中每有4mol电子转移,则生成N2质量为g。
(12分) 金属冶炼和处理常涉及许多反应。
(1)由下列物质冶炼相应金属时采用电解法的是______
a.Fe2O3b.NaClc.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S + 2H2SO4 + 5O2 = 4CuSO4 + 2H2O,
该反应的还原剂是______,当1molO2发生反应时,还原剂所失电子的物质的量为______mol。
(3)下图为电解精炼银的示意图,______(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为。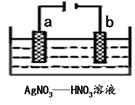
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为,其总反应式为:。
(5)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g)
已知:①FeO(s) + CO(g) = Fe(s) + CO2(g)△H1=-11KJ/mol
②3Fe2O3(s) + CO(g) = 2Fe3O4(s) + CO2(g)△H2=-47KJ/mol
③Fe3O4(s) + CO(g) = 3FeO(s) + CO2(g)△H3=+19KJ/mol
则反应Fe2O3(s) + 3CO(g)= 2Fe(s)+ 3CO2(g)的△H= 。