现有A、B、C、D四种常见的短周期主族元素,它们之间的关系如下:
I.原子半径:A<C<B<D
II.原子的最外 层电子数:A+C=B+D=8
III.原子的核外电子层数:B=C=2A
IV.B元素的主要化合价:最高正价+最低负价=2
请 回答:
回答:
(1)由A、B两种元素组成的常见气体,其电子式为 ;只有A和B两种元素组成的属于离子晶体的化合物可能为 (用化学式表示)。
(2)由D元素形成的氢氧化物,与强碱溶液反应的离子方程式为 。
(3)由B、C元素组成的化合物BC3,该化合物具有强氧化性,与水反应生成两种酸和一种无色气体,该气体常温下遇空气变红棕色,写出该化 合物与水反应的化学方程式 。
合物与水反应的化学方程式 。
(4)由A、B和C三种元素组成的盐,常温下其水溶液显酸性,则0.1mol·L-1该盐溶液中浓度最大的离子为 (写离子符号)。
(5)由A、B、C和D四种元素组成的配位化合物,其化学式为 ;写出检验该配位化合物中所含阳离子的实验方法 。
用图所示的装置进行电解。通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色。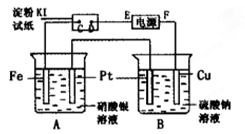
(1)E为电源的极(填“正”或“负”);
(2)A中发生反应的化学方程式为;
(3)在B中观察到的现象是;
(4)室温下,若从电解开始到结束,A、B装置中共 收集到气体0.168 L(标况),若电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求A溶液的pH。
收集到气体0.168 L(标况),若电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求A溶液的pH。
某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及 电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器及装置如下图所示,回答下列问题:
电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器及装置如下图所示,回答下列问题: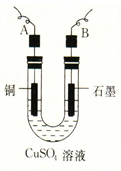
(1)该装置中B电极为电解池的极(填“阴”或“阳”);
(2)A电极上的电极反应式为;
电解池总反应的离子方程式为;
(3)电解过程中,电解质溶液的酸性(填“增强”、“减弱”或“不变”);
(4)下列实验操作中必要的是(填写字母);
| A.称量电解前的电极的质量; |
| B.电解后,电极在烘干称量前,必须用蒸馏水冲洗; |
| C.刮下电解后电极上析出的铜,并清洗,称量; |
D.电解后烘干称重的操作中必须按“烘干→称量 →再烘干→再称量”进行; →再烘干→再称量”进行; |
(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(5)铜的相对原子质量为(用带有m、V的计算式表示)。
为减弱温室效应,除了减少CO2的排放、植树造林、将液态CO2注入深海等措施外,还有一种思路是将CO2转化成其它可燃物质。如工业上已实现CO2和H2反应生成甲醇的转化。已知:在一恒温、恒容密闭容器中充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) =CH3OH(g)+H2O(g)


 △H= -49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答
△H= -49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答 :
: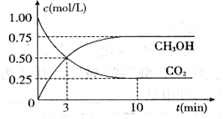
(1)达到平衡的时刻是____________min(填“3”或“10”)。 在前10min内,用CO2表示的反应速率
在前10min内,用CO2表示的反应速率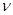 (CO2)="________"
(CO2)="________"
(2)能判断该反应达到化学平衡状态的依据是。 a.容器压强不变 b.混合气体中c(CO2)不变
a.容器压强不变 b.混合气体中c(CO2)不变
c. (CH3OH)=
(CH3OH)= 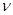 (H2O) d.c(CH3
(H2O) d.c(CH3 OH)=c(H2O)
OH)=c(H2O) (3)为了提高H2的转化率,可采取__________(填“增大”或“减小”)CO2浓度的措施。
(3)为了提高H2的转化率,可采取__________(填“增大”或“减小”)CO2浓度的措施。
(4)达平衡后,H2的转化率是_____________。平衡常数K=____________。(计算结果保留一位小数)
在常温下,下列五种溶液:①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4③0.1mol/L NH4HSO4④0.1mol/L NH3·H2O和 0.1mol/L NH4Cl混合液⑤0.1mol/L NH3·H2O请根据要求填写下列空白:
②0.1mol/L CH3COONH4③0.1mol/L NH4HSO4④0.1mol/L NH3·H2O和 0.1mol/L NH4Cl混合液⑤0.1mol/L NH3·H2O请根据要求填写下列空白:
(1)溶液①呈性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)
(2)在上述五种溶液中,pH最小的是;c(NH4+)最小的是﹝填序号﹞
(3)比较溶液②、③中c(NH4+)的大小关系是②③﹝填“>”、“<”或“=”)
(4)在溶液④中NH3·H2O和离子的物质的量浓度之和为0.2 mol/L。
甲烷、乙烷的一氯取代物不存在同分异构体,则碳原子数少于10的烷烃分子中还有哪些烷烃的一氯取代物也不存在同分异构体?请写出这些烷烃的结构简式。(有几种写几种)