为减弱温室效应,除了减少CO2的排放、植树造林、将液态CO2注入深海等措施外,还有一种思路是将CO2转化成其它可燃物质。如工业上已实现CO2和H2反应生成甲醇的转化。已知:在一恒温、恒容密闭容器中充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) =CH3OH(g)+H2O(g)


 △H= -49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答
△H= -49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答 :
: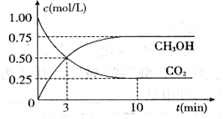
(1)达到平衡的时刻是____________min(填“3”或“10”)。 在前10min内,用CO2表示的反应速率
在前10min内,用CO2表示的反应速率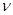 (CO2)="________"
(CO2)="________"
(2)能判断该反应达到化学平衡状态的依据是 。 a.容器压强不变 b.混合气体中c(CO2)不变
a.容器压强不变 b.混合气体中c(CO2)不变
c.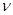 (CH3OH)=
(CH3OH)= 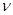 (H2O) d.c(CH3
(H2O) d.c(CH3 OH)=c(H2O)
OH)=c(H2O) (3)为了提高H2的转化率,可采取__________(填“增大”或“减小”)CO2浓度的措施。
(3)为了提高H2的转化率,可采取__________(填“增大”或“减小”)CO2浓度的措施。
(4)达平衡后,H2的转化率是_____________。平衡常数K=____________。(计算结果保留一位小数)
已知25℃、101kPa下,氢气、甲烷和葡萄糖的燃烧热依次为285.8 kJ/mol、890.3kJ/mol、2800 kJ/mol。
(1)0.1mol甲烷和0.2mol氢气组成的混合气体在25℃、101kPa下完全燃烧释放的热量为;
(2)写出表示葡萄糖燃烧热的热化学方程式:;
(3)有人利用甲烷和氧气的反应设计成如图所示燃料电池,若使用酸性电解质溶液,则两极的电极反应式为:
a极:,b极:;
若使用碱性电解质溶液,则b极的电极反应式为:b极:;
放电时电极a作极,外电路中电流从流向,电解质溶液中阳离子移向极;
(10分)在Cl-、Al3+、HSO4-、K+、HS-五种离子中,既不能电离又不能水解的离子是,只能水解不能电离的离子是,只能电离不能水解的离子是,既能电离又能水解的离子是,能促进水电离的离子是,能抑制水的电离的离子是,写出阴离子水解的离子方程式。
有机物A的分子式为C3H4O2,下图是A~H 间相互转化的关系图,其中F中含有一个七元环;H是一种高分子化合物。
已知:
①羟基与双键碳原子相连的醇不存在;
②同一个碳原子上连有两个或多个羟基的多元醇不存在。
请根据以上信息填空:
⑴指出下列反应的反应类型:A→C;E→G。
⑵写出A中含有官能团的结构简式:。
⑶写出C和F的结构简式:C;F。
⑷G 中不同化学环境的氢原子有种。
⑸完成下列反应的化学方程式:
A→H;
B→D(第①步);
E→G。
X、Y、T、Q 四种元素,位于元素周期表前四周期,元素的性质或结构信息见下表。
| 元素 |
性质或结构信息 |
| X |
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。 |
| Y |
二价阳离子的外围电子层排布为3d9 |
| T |
原子核外s轨道电子总数等于p轨道电子总数;人体内含量最多的元素,且其单质是常见的助燃剂。 |
| Q |
第三周期主族元素中原子半径最小。 |
请根据上述信息回答下列问题:
⑴ 写出 X3- 的一种等电子体的化学式; X的气态氢化物易液化的原因是:。
⑵写出T元素基态原子的核外电子排布图;
Q元素的原子核外有种运动状态不同的电子。
⑶元素 X 、T 的电负性相比,的小(填元素名称);元素 X 的第一电离能与T相比较,T的(填“大”或“小”)。
⑷甲醛(CH2O)分子中σ 键与π 键的个数之比为。
⑸Y元素在周期表中位于区。Y单质晶体的晶胞如右图所示,
该晶胞中实际拥有个原子,该晶体中Y原子在三维空间里的
堆积方式为堆积。
⑹在Y的硫酸盐溶液中通入X的气态氢化物至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。此蓝色沉淀溶解的离子方程式为:。
⑺元素X与Q可形成化合物XQ3,根据价层电子对互斥理论判断XQ3的空间构型为:,分子中X原子的杂化方式为杂化。
有A、B、C、D四种强电解质,它们在水中可电离出下列离子(每种物质只含一种阳离子和一种阴离子,且互不重复)。
| 阳离子 |
Na+、K+、Ba2+、NH4+ |
| 阴离子 |
SO42-、Cl-、OH-、CH3COO- |
已知:
①A、C溶液的pH均大于7,B溶液的pH小于7;D溶液焰色反应显黄色。
②C溶液与D溶液混合后生成白色沉淀;B溶液与C溶液混合后生成有刺激性气味的气体。
⑴B中阳离子是(填化学式)。
⑵写出C溶液与D溶液反应的离子方程式:。
⑶25℃时,pH=9的A溶液和pH=9的C溶液中水的电离程度小的是(填A或C的化学式)。
⑷25℃时,用惰性电极电解 D 的水溶液,一段时间后溶液的pH_____7(填“>”、“<”或“=”)。
⑸将等体积等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为。
⑹25℃时,在一定体积0.2 mol · L—1的C溶液中,加入一定体积的0.1 mol · L-1的盐酸时,混合溶液的pH=13。若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是____。