如图是可用于测量阿伏加德罗常数的装置示意图,其中A是纯铜片、B是石墨,插在100mLCuSO4稀溶液中,铜片、石墨与引出导线相连,引出端分别为X、Y。
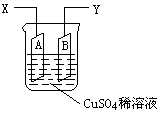
(1)当以IA的电流电解6min后,测得铜片A质量减少2.56g,则图装置中的X端应与直流电的 极相连。
(2)电解后将电源反接,2IA的电流电解6min后,假设溶液体积不变,测得溶液中CuSO4物质的量浓度为0.1mol/L,则原溶液中CuSO4物质的量浓度 mol/L。溶液中H+的物质的量浓度为 mol/L。
(3)列式计算实验测得的阿伏加德罗常数NA(用I表示) mol-1。(已知电子电量e=1.60×10–19C)
(6)某离子晶体的晶胞结构如图所示。试求: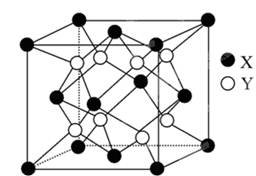
(1)晶体中每一个X同时吸引着________Y,每个Y同时吸引着________个X,该晶体的化学式是________________________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有________个。
(3)晶体中距离最近的2个X与一个Y形成的夹角(∠XYX)为________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ g·cm-3,阿伏加德罗常数为NA,则晶体中两个距离最近的X的核间距离为________cm。
原子序数依次增大的短周期元素A、B、C、D、E、F,其中 A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,F能形成与A相同价态的阴离子,且A离子半径小于F离子。回答:
(1)B元素的名称为。
(2)A与F可形成两种中学化学常见的化合物,其分子式分别为和;分子空间构型分别为。
(3)请写出基态原子E的价电子排布式
(4)上述六种元素按电负性从大到小的排列是(写元素符号表示)。
(5)C、D、E、F元素第一电离能从小到大的排列是(写元素符号);
(6)A、B、C、D四种元素的简单离子按半径由小到大的顺序为(用离子符号表示)__________________________。
(7)C与A形成的化合物属于晶体,此化合物和NaCl固体相比较熔点的高低关系为
(用化学式表示大小关系),原因是。
下表为元素周期表的一部分,期中的编号代表对应的元素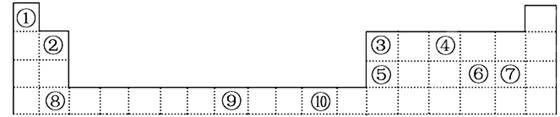
请回答下列问题:
(1)表中属于ds区的元素是________(填编号)。
(2)写出元素⑨的高价离子的电子排布式_____________________________。
(3)某元素的最外层电子排布式为nsnnpn+1,该元素原子的核外共有________种不同运动状态的电子。该元素在周期表中的位置是上表中相对应的(填编号),该元素的气态氢化物沸点较高的原因是
(4)⑥、⑦分别①形成的化合物稳定性较强的为(化学式表示)
(11)E的产量是衡量一个国家石油化工发展水平的标志,并能进行如图所示的反应。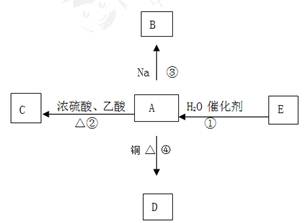
(1)写出A的官能团名称
(2)下列反应的化学方程式
反应①: 发生的反应类型
反应②: 发生的反应类型
反应④: 发生的反应类型
(3)比较:反应①剧烈程度(填>、= 或<)钠和水反应的剧烈程度
某芳香烃的分子式是C8H10,它可能有的同分异构体共有种,
其中在苯环上的一溴代物有三种的是(写出可能的结构简式)。