(14分) “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000 kJ·m-3的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:
C(s)+O2(g)=CO2(g) ΔH1=—393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(g) ΔH2=—483.6 kJ·mol-1 ②
C(s)+H2O(g)=CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1 ③
则反应CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= kJ·mol-1。标准状况下的煤炭气(CO、H2)33.6 L与氧气完全反应生成CO2和H2O,反应过程中转移 mol e-。
(2)工作温度650℃的熔融盐燃料电池,是用煤炭气(CO、H2)作负极燃气,空气与CO2的混合气体在正极反应,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为 。
(3)密闭容器中充有10 mol CO与20 mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)  CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如右图所示。
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如右图所示。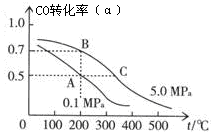
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为VAL,则该温度下的平衡常数K= ;A、B两点时容器中物质的物质的量之比为n(A)总:n(B)总= 。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是 。
A 降温 B 加压 C 使用催化剂 D 将甲醇从混合体系中分离出来
某些非金属单质可以与强碱溶液发生反应。例如白磷(P4)可以与过量的热NaOH溶液反应生成PH3气体和NaH2PO2(次磷酸钠)。
(1)上述反应的化学方程式为 。
(2)已知NaH2PO2水溶液pH>7,次磷酸是 元(填“一”、“二”或“三”) (填“强”或“弱”)。次磷酸的电离方程式为: ;NaH2PO2水溶液pH>7的原因: 。
(3)25℃时,向100mL0.01mol∙L-1的H3PO2溶液中,滴加等浓度的NaOH溶液至溶液呈中性,消耗NaOH溶液的体积 (填“>”、“=”或“<”)100ml。此时溶液中离子浓度由大到小的顺序是 。
T℃时,向体积为2L的恒容密闭容器中充入4molA和2molB气体,发生如下反应:4A(g)+B(g) xC(g),保持温度不变,5min时反应达到平衡状态,剩余1.6 molB,并测得C的浓度为0.8mol/L,请填写下列空白:
xC(g),保持温度不变,5min时反应达到平衡状态,剩余1.6 molB,并测得C的浓度为0.8mol/L,请填写下列空白:
(1)x=__________,该反应平衡常数的表达式为:K= 。
(2)该温度下,此反应达到平衡时,A的转化率为α(A)= 。
(3)在T℃时,若向原平衡混合物的容器中再充入amolC,同时改变容器体积保持压强不变,欲使达到新的平衡时,各物质的体积分数与原平衡相同,则应再充入________molB (用a表示)。
将5.3 g某碱式碳酸盐固体(不含结晶水)M溶解于100 g 9.8%的稀硫酸中,充分反应后得到224 mL CO2(标准状况)和含有MgSO4、Al2(SO4)3的溶液。向所得溶液中逐滴加入NaOH溶液,产生沉淀的质量与加入的溶质NaOH的质量关系如图所示。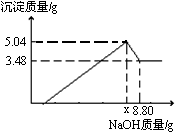
(1)由图可知,固体M与稀硫酸反应后所得溶液中除含有溶质MgSO4和Al2 (SO4)3外,还含有的溶质是______(写化学式)。
(2)加入的溶质NaOH从0.8 g到xg所发生反应的离子方程式为 。
(3)当加入溶质NaOH的质量到xg时,生成Al(OH)3的质量为 g,x= 。
(4)M的化学式为____。
(12分) 软锰矿(主要成分MnO2,含Fe,Al2O3,MgO杂质)的水悬浊液与烟气中的SO2反应可制备MnSO4·H2O,MnO2与SO2反应的化学方程式为MnO2 +SO2=MnSO4。已知下列信息: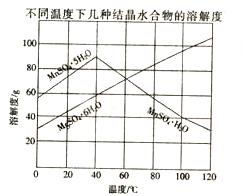
室温下几种氢氧化物的溶度积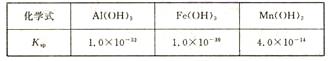
回答下列问题:
(1)质量为17.40 g纯净MnO2最多能氧化 L(标准状况) SO2。
(2)悬浊液吸收烟气后,Fe首先转化为Fe2+进入溶液,然后被 氧化为Fe3+;要证明溶液中存在Fe3+,可选择的试剂是 (填标号)。
a.KMnO4溶液b.KCl溶液c.KSCN溶液d.KNO3溶液
(3)室温下,将吸收液过滤,在滤液中加入CaCO3,可除去MnSO4溶液中的Fe3+、Al3+,原因是 。
(4)从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为 。
硅是信息产业、太阳能电池光电转化的基础材料。锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意如下: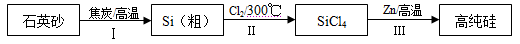
(1)焦炭在过程Ⅰ中作______剂。
(2)过程Ⅱ中的Cl2用电解饱和食盐水制备,制备Cl2的化学方程式是 。
(3)整个制备过程必须严格控制无水。
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应的化学方程式是 。
②干燥Cl2时,从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入到浓H2SO4中。冷却的作用是 。
(4)Zn还原SiCl4的反应如下:
反应1:400℃~756℃,SiCl4(g) + 2Zn(l)  Si(s) + 2ZnCl2(l) ΔH1 <0
Si(s) + 2ZnCl2(l) ΔH1 <0
反应2:756℃~907℃,SiCl4(g) + 2Zn(l)  Si(s) + 2ZnCl2(g) ΔH2 <0
Si(s) + 2ZnCl2(g) ΔH2 <0
反应3:907℃~1410℃,SiCl4(g) + 2Zn(g)  Si(s) + 2ZnCl2(g) ΔH3 <0
Si(s) + 2ZnCl2(g) ΔH3 <0
① 对于上述三个反应,下列说法合理的是_____。
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应的速率 d.Na、Mg可以代替Zn还原SiCl4
② 实际制备过程选择“反应3”,选择的理由是 。
③ 已知Zn(l)==Zn(g) ΔH =" +116" KJ/mol 。若SiCl4的转化率均为90%,每投入1mol SiCl4,“反应3”比“反应2”多放出_____kJ的热量。
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,采用化学腐蚀法在其表面形成粗糙的多孔硅层。腐蚀剂常用稀HNO3和HF的混合液。硅表面首先形成SiO2,最后转化为H2SiF6。用化学方程式表示SiO2转化为H2SiF6的过程 。